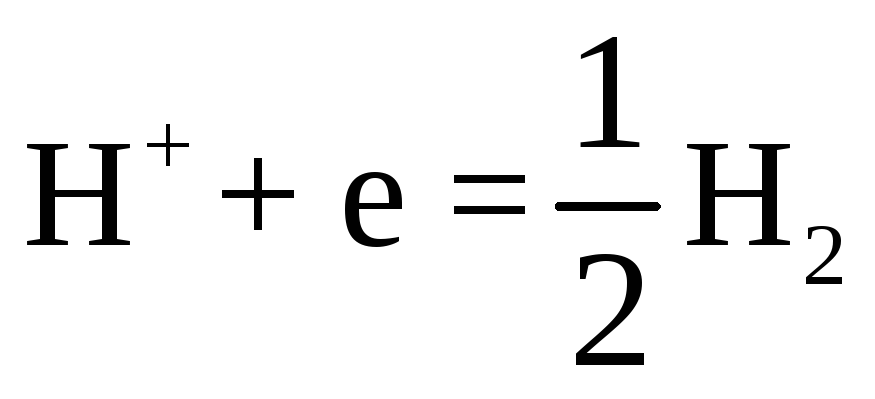4.4. Морская коррозия
Коррозии в морской воде подвержены металлические части морских судов, механизмы и трубопроводы, металлические сооружения морских портов и т. д. Морская вода является хорошо аэрированным, нейтральным электролитом с высокой электропроводностью, обусловленной наличием в ней солей с большим содержанием хлоридов, оказывающих депассивирующее действие.
Механизм морской коррозии металлов электрохимический, преимущественно с кислородной деполяризацией. На скорость морской коррозии оказывают влияние состав морской воды, ее температура и скорость движения, дополнительный механический фактор (аэрирование, кавитация), контакт разнородных металлов, биологический фактор (обрастание подводной части металлических сооружений морскими растительными и животными организмами).
Общая концентрация солей в морской воде достигает 4%, что влияет на ее электропроводность. Йод и бром играют роль дополнительных катодных деполяризаторов и ускоряют коррозию. Хлор-ион является сильным депассиватором, т. е. ускоряет анодный процесс коррозии металлов. Сероводород подкисляет морскую воду и связывает ионы металлов в труднорастворимые сульфиды, облегчая протекание анодного и катодного электродных процессов электрохимической коррозии. При прохождении электрического тока через подводную часть судов и морских сооружений возникает их электрокоррозия.
Большое влияние на скорость коррозии в морской воде оказывает глубина погружения. Скорость коррозии металлов резко уменьшается с глубиной погружения, что связано с уменьшением содержания кислорода в воде. На глубине 1000 м наблюдается минимум скорости коррозии, что соответствует достижению минимального содержания кислорода в морской воде.
Относительно высока скорость коррозии морских судов по ватерлинии. Особенно интенсивно процесс разрушения металла развивается в зоне, расположенной несколько выше этой линии. Этому способствует облегченный доступ кислорода, смывание защитных пленок с поверхности, периодическое ее смачивание электролитом с последующим высыханием, перепадом температур.
Наиболее распространенным методом защиты металлов от коррозии в морской воде является нанесение лакокрасочных покрытий. Используют также цинковые и кадмиевые покрытия как самостоятельные или как подслой под лакокрасочные. Широкое применение находит электрохимическая защита морских судов и сооружений, а также применение некоторых коррозионно-стойких сплавов (например, сплав меди с никелем).
4.5. Коррозия в расплавленных солях
Расплавленные соли широко используются в промышленности при производстве электролитическим способом ряда металлов (алюминий, литий, натрий, магний и др.) в качестве нагревающих сред при термической обработке, как теплоносители в теплоэнергетике. Металлы, соприкасаясь с расплавленными солями, взаимодействуют с ними и подвергаются коррозионному разрушению.
При погружении металлов в расплавленные соли, являющиеся электролитами, в результате взаимодействия между ними возникает разность электрических потенциалов (электродные потенциалы в расплавленных солях). Значения этих потенциалов зависят от природы анионов расплава и существенно отличаются от электродных потенциалов в водных растворах по величине и расположению в электрохимическом ряду напряжений. Для некоторых металлов (серебро, цинк, свинец и др.) установлено, что в расплавах своих солей они ведут себя обратимо и их электродные потенциалы соответствуют термодинамическому уравнению:
(4.1)
Для большинства металлов в расплавах их солей устанавливается необратимый или стационарный электродный потенциал.
Коррозия металлов в расплавленных солях является электрохимической и состоит из двух сопряженных электродных процессов:
— анодного (окисление металла):
;
— катодного (ассимиляция электронов деполяризатором):
.
Катодными деполяризаторами в расплавленных солях, по данным Н. Д. Томашова, могут быть растворенный в расплаве кислород, вода необезвоженного расплава, некоторые катионы:
;
;
;
.
Условием возможности самопроизвольного протекания коррозионного процесса в расплавах является убыль изобарно-изотермического потенциала реагирующей системы, т.е. ∆G < 0. Электрохимическое растворение металлов в расплавах хлористых солей идет в основном на анодных участках - границах зерен, а центральные части зерен являются микрокатодами.
При высоких температурах в расплавленных солях углеродистые стали, помимо их коррозионного растворения, подвергаются обезуглероживанию кислородом воздуха, влаги. Обычно чем агрессивнее расплав в коррозионном отношении, тем сильнее в нем идет обезуглероживание сталей.
На скорость коррозии в расплавленных солях оказывают влияние вид соли, кислород и различные добавки. Расплавы сульфатов агрессивнее расплавов хлоридов, так как сульфат-ион является катодным деполяризатором. Расплавы нитратов еще агрессивнее, так как нитрат-ион представляет собой активный катодный деполяризатор. Пропускание через расплав соли кислорода, воздуха или водяного пара приводит к увеличению скорости коррозии, так как облегчается катодный процесс. Коррозию сталей в расплавах солей снижает добавка таких веществ, как графит, активированный уголь, бура и другие восстановители, понижающие окислительную способность расплавов.
Для защиты металлов от коррозии в расплавленных солях используются следующие методы: применение менее агрессивных расплавов; снижение содержания в расплавах вредных примесей; максимальное снижение скоростей конвективных потоков; электрохимическая катодная защита.
Источник
Морская коррозия
Морская вода является хорошо аэрированным (4-10 мг/л О2) нейтральным (рН = 7,3-8,6) электролитом с высокой электропроводностью (γ=0,5-6,7 См/м), обусловленной наличием солей от 2 (воды заливов, моря в местах впадения рек) до 40%. Средняя соленость открытых морей и океанов составляет 35%.
Солевой состав морской воды включает в себя в основном хлориды и сульфаты натрия, магния, кальция и калия. Благодаря большому содержанию хлоридов морская вода характеризуется высокой способностью к депассивации металлов. Морская коррозия металлов протекает по электрохимическому механизму преимущественно с кислородной деполяризацией и смешанным диффузионно-кинетическим катодным контролем.
Для разрушения металлов в морской воде характерно наряду с общей равномерной коррозией наличие разрушений в виде язв и питтинга. Средняя скорость коррозии стали в морской воде, рассчитанная по потере массы, составляет от 0,05 до 0,20 мм/год, а язвенной коррозии — до 1 мм/год. Холодное цинкование в среднем имеет скорость коррозии около 0,02 мм/год
На скорость коррозии металлов в морской воде оказывает влияние ряд факторов. Общая соленость морской воды не сильно влияет на интенсивность коррозионного процесса, в то время как некоторые отклонения от обычного состава, например, наличие сероводорода или различных загрязнений могут в несколько раз увеличить скорость коррозии.
Так, исследования коррозии корпусных конструкций в акваториях базирования кораблей ВМФ в Индии показали скорости коррозии углеродистых и низколегированных сталей в 8-10 раз большие по сравнению со средними значениями скорости коррозии стали в морской воде.
Движение морской воды увеличивает скорость доставки кислорода к катодным участкам поверхности металла, а отсюда и скорость коррозии большинства металлов. В то же время для коррозионностойких сталей увеличение диффузии кислорода приводит к усилению пассивации поверхности и защите от питтинга.
При еще более значительных скоростях движения как морской, так и пресной воды могут появиться коррозионно-эрозионные разрушения, когда электрохимическая коррозия сильно ускоряется вследствие разрушения потоком воды защитной пленки на металле (пленки пассивности или продуктов коррозии). К таким разрушениям особенно склонны цинк, алюминий, медь и медные сплавы.
При очень быстром движении воды наблюдается коррозионная кавитация, когда наряду с коррозионным процессом происходит механическое разрушение металла ударным воздействием воды при смыкании вакуумно-паровых пузырьков. Скорости коррозионной кавитации могут достигать десятков миллиметров в год.
Температура воды двояко влияет на скорость коррозии: с одной стороны, повышение температуры ускоряет диффузию кислорода и реакции на анодных и катодных участках, а, с другой стороны, уменьшает растворимость кислорода, а отсюда и скорость коррозии.
Поэтому зависимость скорости коррозии от температуры воды имеет вид кривой с максимумом, соответствующим различным температурам при различных условиях (тип сплава, состав воды, возможности сохранения кислорода в закрытых системах и т.п.).
Металлический контакт разнородных металлов в морской воде приводит к усилению коррозии более электроотрицательного металла и снижению (или подавлению) коррозии более положительного металла. Заключение о коррозионном поведении контакта различных металлов можно сделать на основании сопоставления их стационарных потенциалов в данной среде. При неправильном выборе контактирующих металлов и отсутствии средств защиты возникает опасность весьма значительных коррозионных повреждений.
На интенсивность коррозии металлов в морской воде может оказать влияние обрастание поверхности морскими организмами (биокоррозия). На коррозию углеродистых и низколегированных сталей обрастание не оказывает особо заметного влияния, причем коррозия может при этом как усиливаться (при наличии сульфатредуцирующих бактерий, возникновении пар дифференциальной аэрации), так и уменьшаться (вследствие снижения содержания кислорода и кроющего действия обрастателей).
Влияние обрастания на коррозию нержавеющих сталей, алюминиевых и медных сплавов также неоднозначно, но в целом преобладает отрицательное влияние. Объясняется это тем, что эти материалы склонны к щелевой коррозии в зазорах, образуемых обрастателями, и к усилению коррозии при нарушениях сплошности пассивной пленки в связи с уменьшением содержания кислорода.
Резкое усиление коррозии металлоконструкций в морской воде, иногда в десятки раз, может иметь место в зоне действия блуждающих токов или токов утечки, когда поверхность металла подвергается сильной анодной поляризации под действием стекающего тока.
Источник