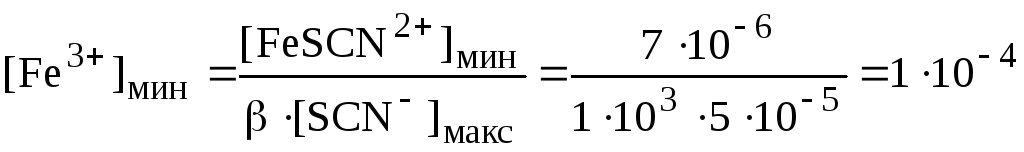- 16.2.2. Способы обнаружения конечной точки титрования
- Метод Мора
- Метод Фольгарда
- Способы обнаружения конечной точки титрования методы мора фольгарда фаянса
- Что такое метод Мора?
- Что такое метод Фольхарда?
- Что такое метод фаянса
- В чем разница между методом Мора Фольхарда и Фаянса?
- Резюме — метод Мора Фольхарда и Фаянса
- 16.2.2. Способы обнаружения конечной точки титрования
- Метод Мора
- Метод Фольгарда
16.2.2. Способы обнаружения конечной точки титрования
Для обнаружения конечной точки титрования в аргентометрии могут быть использованы визуальные или инструментальные методы. Визуальные методы традиционно называют по их авторам.
Метод Мора
В данном методе в качестве индикатора для обнаружения конечной точки титрования используется хромат калия. Хромат калия в аргентометрии представляет собой осадительный индикатор.
Осадительными индикаторами называются вещества, выделяющиеся из раствора в виде осадка в хорошо заметной форме в точке эквивалентности или вблизи неё.
Величина произведения растворимости у Ag2CrO4 (KS = 1,110 -12 ) меньше, чем у AgCl, но растворимость в воде больше (6,510 -5 моль/л и 1,310 -5 моль/л соответственно). При титровании 0,10 М NaCl 0,10 М раствором AgNO3 в точке эквивалентности pAg = 4,87 (табл. 16.1). Следовательно, pCrO4 = pKs(Ag2CrO4) – 2pAg = 2,2, моль/л. Нижней (pAg = 5,4) и верхней (pAg = 4,3) границам скачка титрования соответствуют концентрации CrO4 2- , равные, соответственно, 110 -1 и 410 -4 моль/л. Практически обнаружение конечной точки титрования проводят при концентрациях дихромат-иона 0,005 – 0,01 моль/л. Для того чтобы учесть количество титранта, необходимое для образования минимального визуально обнаруживаемого количества Ag2CrO4, проводят контрольный опыт. В качестве модельного титруемого объекта при его выполнении берут суспензию CaCO3.
Метод Мора используется для определения хлорид- или бромид-ионов в нейтральных или слабощелочных растворах.
Метод Мора не используется для определения иодид- и тиоцианат ионов. Осадки AgI и AgSCN адсорбируют большое количество хромат- ионов, поэтому чёткое обнаружение конечной точки титрования становится невозможным. При использовании метода Мора в растворе не должны присутствовать катионы (например, Ba 2+ ), образующие малорастворимые окрашенные хроматы.
Метод Фольгарда
В методе Фольгарда в качестве индикатора применяют железо-аммонийные квасцы.
Вторую часть аргентометрического титрования по методу Фольгарда иногда выделяют в самостоятельный титриметрический метод анализа – тиоцианатометрию. Данный метод используется для определения ионов Ag + .
Визуально появление красной окраски можно обнаружить, если концентрация FeSCN 2+ ( = 1,010 3 ) станет больше, чем 710 -6 моль/л. При титровании 0,1 М AgNO3 0,1 М NH4SCN нижней границе скачка титрования будет соответствовать pSCN = 7,7, а верхней – 4,3 (pKs осадка AgSCN равен 11,97). Концентрации тиоцианат-ионов в нижней и верхней границах скачка титрования будут равны, соответственно, 210 -8 и 510 -5 моль/л. Появление окраски тиоцианатного комплекса будет происходить в пределах скачка титрования при концентрации ионов Fe 3+ :
Практически обнаружение конечной точки титрования проводят при концентрации Fe 3+ 0,01 – 0,015 моль/л (1-2 мл насыщенного раствора железоаммонийных квасцов на 100 мл титруемого раствора).
Титрование по Фольгарду проводят в сильнокислой среде для того, чтобы препятствовать образованию окрашенных гидроксокомплексов Fe(III) из бесцветного аква-комплекса [Fe(H2O)6] 3+ . Для создания кислой среды используют HNO3 (или H2SO4). Концентрация HNO3 в титруемом растворе должна быть не менее 0,3 моль/л.
Источник
Способы обнаружения конечной точки титрования методы мора фольгарда фаянса
В ключевое отличие между методом Мора Фольхарда и Фаянса заключается в том, что Метод Мора относится к реакции между ионом серебра и галогенид-ионом в присутствии хроматного индикатора, но метод Фольгарда относится к реакции между избыточными ионами серебра и галогенид-ионами. Между тем, метод Фаянса относится к реакции адсорбции между галогенидом серебра и флуоресцеином..
Метод Мора, метод Фольхарда и метод Фаянса являются важными аналитическими методами, которые можно использовать в качестве реакций осаждения для определения концентрации галогенида в данном образце. Эти методы названы в честь ученых, разработавших метод.
1. Обзор и основные отличия
2. Что такое метод Мора
3. Что такое метод Фольгарда
4. Что такое метод фаянса
5. Сравнение бок о бок — метод Мора Фольхарда и Фаянса в табличной форме
6. Резюме
Что такое метод Мора?
Метод Мора — это аналитический метод, с помощью которого мы можем определить концентрацию галогенидов путем прямого титрования. В методе используются нитрат серебра и образец, содержащий галогенид-ионы. Обычно этим методом определяется количество хлорид-ионов. Здесь мы используем индикатор для определения конечной точки титрования; Хромат калия является индикатором.
В методе Мора мы должны добавить в образец нитрат серебра из бюретки. Индикатор также добавляется в образец перед началом титрования. Затем ионы хлорида в образце реагируют с добавленными катионами серебра, образуя осадок хлорида серебра. Когда все ионы хлорида осаждаются, добавление еще одной капли нитрата серебра изменит цвет индикатора хромата калия, указывая на конечную точку титрования. Изменение цвета связано с образованием красного осадка хромата серебра. Но этот красный осадок не образуется вначале, потому что растворимость хлорида серебра очень мала по сравнению с растворимостью хромата серебра.
Кроме того, для этого метода требуется нейтральная среда; если мы используем щелочной раствор, то ионы серебра вступают в реакцию с ионами гидроксида до образования осадка хлорида серебра. Кроме того, мы не можем использовать кислые среды, потому что здесь ионы хромата имеют тенденцию превращаться в ионы дихромата. Следовательно, мы должны поддерживать pH раствора около 7. Кроме того, поскольку это метод прямого титрования, также будет ошибка при определении конечной точки. Например, чтобы получить насыщенный цвет, нам нужно использовать больше индикаторов. Тогда количество ионов серебра, необходимое для осаждения этих хромат-ионов, велико. Таким образом, это дает немного большее значение, чем фактическое значение.
Что такое метод Фольхарда?
Метод Фольгарда — это аналитический метод, с помощью которого мы можем определить концентрацию галогенидов путем обратного титрования. В этом методе мы можем сначала титровать раствор хлорида ионами серебра, добавив избыточное количество серебра, а затем определить избыточное содержание ионов серебра в образце. В этом эксперименте индикатор представляет собой раствор, содержащий ион трехвалентного железа, который может давать красный цвет с ионами тиоцианата. Избыточное количество ионов серебра титруют раствором тиоцианат-иона. Здесь тиоцианат имеет тенденцию реагировать с ионами серебра, а не с ионами трехвалентного железа. Однако после использования всех ионов серебра тиоцианат вступит в реакцию с ионами трехвалентного железа.
В этом эксперименте индикаторная система очень чувствительна и обычно дает лучшие результаты. Однако мы должны поддерживать кислотность раствора, потому что ионы трехвалентного железа имеют тенденцию образовывать гидроксид трехвалентного железа в присутствии основной среды.
Что такое метод фаянса
Метод Фаянса — это аналитический метод, с помощью которого мы можем определить концентрацию галогенидов путем адсорбции. В этом методе флуоресцеин и его производные адсорбируются на поверхности коллоидного хлорида серебра.После того, как эти адсорбированные ионы занимают все ионы хлорида, добавление еще одной капли флуоресцеина вступает в реакцию с ионами серебра, образуя осадок красного цвета.
В чем разница между методом Мора Фольхарда и Фаянса?
Метод Мора, метод Фольхарда и метод Фаянса являются важными аналитическими методами, которые можно использовать в качестве реакций осаждения для определения концентрации галогенида в данном образце. Ключевое различие между методом Мора-Фольхарда и Фаянса заключается в том, что метод Мора относится к реакции между ионом серебра и галогенид-ионом в присутствии хроматного индикатора, а метод Фольгарда относится к реакции между избыточными ионами серебра и галогенид-ионами. Тогда как метод Фаянса относится к реакции адсорбции между галогенидом серебра и флуоресцеином.
Ниже инфографика резюмирует разницу между методом Мора Фольхарда и Фаянса.
Резюме — метод Мора Фольхарда и Фаянса
Метод Мора, метод Фольхарда и метод Фаянса являются важными аналитическими методами, которые можно использовать в качестве реакций осаждения для определения концентрации галогенида в данном образце. Метод Мора представляет собой реакцию между ионом серебра и галогенид-ионом в присутствии хроматного индикатора, тогда как метод Фольгарда относится к реакции между избыточными ионами серебра и галогенид-ионами. С другой стороны, метод Фаянса относится к реакции адсорбции между галогенидом серебра и флуоресцеином. Итак, это ключевое различие между методами Мора Фольхарда и Фаянса.
Источник
16.2.2. Способы обнаружения конечной точки титрования
Для обнаружения конечной точки титрования в аргентометрии могут быть использованы визуальные или инструментальные методы. Визуальные методы традиционно называют по их авторам.
Метод Мора
В данном методе в качестве индикатора для обнаружения конечной точки титрования используется хромат калия. Хромат калия в аргентометрии представляет собой осадительный индикатор.
Осадительными индикаторами называются вещества, выделяющиеся из раствора в виде осадка в хорошо заметной форме в точке эквивалентности или вблизи неё.
Величина произведения растворимости у Ag2CrO4 (KS = 1,110 -12 ) меньше, чем у AgCl, но растворимость в воде больше (6,510 -5 моль/л и 1,310 -5 моль/л соответственно). При титровании 0,10 М NaCl 0,10 М раствором AgNO3 в точке эквивалентности pAg = 4,87 (табл. 16.1). Следовательно, pCrO4 = pKs(Ag2CrO4) – 2pAg = 2,2, моль/л. Нижней (pAg = 5,4) и верхней (pAg = 4,3) границам скачка титрования соответствуют концентрации CrO4 2- , равные, соответственно, 110 -1 и 410 -4 моль/л. Практически обнаружение конечной точки титрования проводят при концентрациях дихромат-иона 0,005 – 0,01 моль/л. Для того чтобы учесть количество титранта, необходимое для образования минимального визуально обнаруживаемого количества Ag2CrO4, проводят контрольный опыт. В качестве модельного титруемого объекта при его выполнении берут суспензию CaCO3.
Метод Мора используется для определения хлорид- или бромид-ионов в нейтральных или слабощелочных растворах.
Метод Мора не используется для определения иодид- и тиоцианат ионов. Осадки AgI и AgSCN адсорбируют большое количество хромат- ионов, поэтому чёткое обнаружение конечной точки титрования становится невозможным. При использовании метода Мора в растворе не должны присутствовать катионы (например, Ba 2+ ), образующие малорастворимые окрашенные хроматы.
Метод Фольгарда
В методе Фольгарда в качестве индикатора применяют железо-аммонийные квасцы.
Вторую часть аргентометрического титрования по методу Фольгарда иногда выделяют в самостоятельный титриметрический метод анализа – тиоцианатометрию. Данный метод используется для определения ионов Ag + .
Визуально появление красной окраски можно обнаружить, если концентрация FeSCN 2+ ( = 1,010 3 ) станет больше, чем 710 -6 моль/л. При титровании 0,1 М AgNO3 0,1 М NH4SCN нижней границе скачка титрования будет соответствовать pSCN = 7,7, а верхней – 4,3 (pKs осадка AgSCN равен 11,97). Концентрации тиоцианат-ионов в нижней и верхней границах скачка титрования будут равны, соответственно, 210 -8 и 510 -5 моль/л. Появление окраски тиоцианатного комплекса будет происходить в пределах скачка титрования при концентрации ионов Fe 3+ :
моль/л
моль/л
Практически обнаружение конечной точки титрования проводят при концентрации Fe 3+ 0,01 – 0,015 моль/л (1-2 мл насыщенного раствора железоаммонийных квасцов на 100 мл титруемого раствора).
Титрование по Фольгарду проводят в сильнокислой среде для того, чтобы препятствовать образованию окрашенных гидроксокомплексов Fe(III) из бесцветного аква-комплекса [Fe(H2O)6] 3+ . Для создания кислой среды используют HNO3 (или H2SO4). Концентрация HNO3 в титруемом растворе должна быть не менее 0,3 моль/л.
Источник