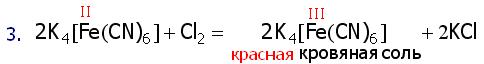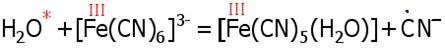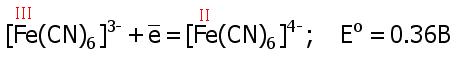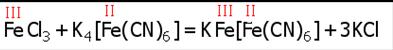Соль Мора
Кристаллы устойчивы на воздухе, но растворимы в воде. При нагревании обезвоживаются и становятся белым порошком.
Хрупкая, гигроскопична, хорошо растворима в воде. При попадании раствора на одежду оставляет ржавые оранжевые пятна.
Морит (утверждён IMA: IMA1964-023)
СПОСОБ СИНТЕЗА (искусственного выделения)
Кристаллы могут быть выращены в домашних условиях. Методом приготовления перенасыщенного раствора соли Мора при температуре 60-70 градусов и дальнейшем остывании данного раствора. Более подробную информацию о данном методе вы можете прочитать в статье: Выращивание кристаллов из растворов солей.
Инструкция по хранению:
1) предохранять от попадания воды и кислот;
2) предохранять от воздействия паров;
3) предохранять от температуры выше 40 градусов;
4) предохранять от длительного воздействия прямых солнечных лучей;
5) при запылении протереть сухой тряпкой/салфеткой;
6) после работы с образцом тщательно мойте руки.
Основные диагностические признаки
Применение
Соль Мора применяется:
1) в медицине/фармацевтике (при нехватке в организме железа и др.);
2) в строительной промышленности (защита деревянных конструкций от гниения);
3) в химической промышленности.
Место продажи реактива — Магазины химических реактивов
| info@kristallov.net Правила копирования и цитирования материалов с сайта Кристаллов.Net MySQL: 0.0000 s, 0 request(s), PHP: 0.1537 s, total: 0.1537 s, document retrieved from cache. |
| Карта сайта |
| © Кристаллов.net | Kristallov.net Copyright 2010-2017 Систематика и классификация минералов, горных пород, метеоритов, окаменелостей |
Источник
Соль Мора
Сульфат аммония-железа (II) (соль Мора) — неорганическое соединение, двойная сернокислая соль железа и аммония с формулой Fe(NH4)2(SO4)2.
Свойства
Химическая формула: FeSO4·(NH4)2SO4·6H2O (или Fe(NH4)2(SO4)2·6H2O). Представляет собой неярко сине-зелёные моноклинные кристаллы. Растворяется в воде. Растворимость соли Мора в воде равна 21,6 г безводного вещества в 100 г воды при 20 °C. В кислоте растворимость несколько больше. Устойчива на воздухе. Парамагнетик. Соль Мора используется в медицине (добавляется в пищу, или в виде фармакопейного препарата, при нехватке в организме больного железа), для определения уробилина, в фармацевтике.
Применение
Соль Мора применяется в научно-исследовательских работах и химических лабораториях как удобная форма препарата железа (II): для определения концентрации (титра) перманганата калия в растворах, при определении концентраций хрома и ванадия в растворах этилового спирта и эфира. В растворах ион Fe 2+ даже слабыми окислителями легко окисляется до Fe 3+ .
Также, в виде концентрированных растворов, применяется для пропитки древесины для защиты её от гниения. Имеет и другие применения.
Соль названа в честь немецкого химика Карла Фридриха Мора (1809—1879).
- Алюминат железа II ( Fe(AlO2)2 ) Алюминат железа II
- Арсенат железа II (Fe3(AsO4)2) Железо мышьяковокислое
- Арсенат железа III (FeAsO4) Мышьяковокислое железо
- Ацетат железа II (Fe(CH3COO)2) Железо уксуснокислое
- Ацетат железа III (Fe(CH3COO)3) Уксуснокислое железо
- Берлинская лазурь () Прусская Синь
- Бромид железа II (FeBr2) Бромистое железо
- Бромид железа III (FeBr3) Трибромид железа
- Бромид железа II,III (Fe3Br8) Железо бромистое
- Ванадат железа III (FeVO4) Железо ванадиевокислое
- Вольфрамат железа II (FeWO4) Железо вольфрамовокислое
- Гексаплутонийжелезо (FePu6) Гексаплутонийжелезо
- Гексахлороплатинат IV железа (Fe[PtCl6]) Гексахлороплатеат железа
- Гексацианоферрат II железа II (Fe2[Fe(CN)6]) Гексацианоферрат железа II
- Гексацианоферрат II железа III (Fe4[Fe(CN)6]3) Гексацианоферрат железа III
- Гексацианоферрат III железа II,III (Fe III 4Fe II 3[Fe(CN)6]6) Гексацианоферрат железа II,III
- Гексацианоферрат III железа II (Fe3[Fe(CN)6]2) Турнбулева синь
- Гексацианоферрат II калия (K4[Fe(CN)6]) Желтая кровяная соль
- Гексацианоферрат III калия (K3[Fe(CN)6]) Красная кровяная соль
- Гидроксид железа II (Fe(OH)2) Гидроксид железа II
- Гидроксид железа III (Fe(OH)3) Гидроксид железа III
- Динитрозилдикарбонилжелезо (Fe(CO)2(NO)2) Динитрозилдикарбонилжелезо
- Дипразеодимгептадекажелезо (Fe17Pr2) Гептадекажелезодипразеодим
- Диренийтрижелезо (Fe3Re2) Трижелезодирений
- Дисамарийгептадекажелезо (Fe17Sm2) Гептадекажелезодисамарий
- Диселенид железа (FeSe2) Железо селенистое
- Дисилицид железа (FeSi2) Железо кремнистое
- Дистаннид железа (FeSn2) Дистаннид железа
- Дистаннид трижелеза (Fe3Sn2) Дистаннид трижелеза
- Дисульфид железа II (FeS2) Дисульфид железа
- Дителлурид железа (FeTe2) Дителлурид железа
- Дихромат железа III (Fe2(Cr2O7)3) Хромовокислое железо
- Додекакарбонилтрижелезо (Fe3(CO)12) Додекакарбонилтрижелезо
- Железо (Fe)
- Железистосинеродистая кислота (H4[Fe(CN)6]) Кислота железистосинеродистая
- Железониобий (FeNb) Железониобий
- Железосинеродистая кислота (H3[Fe(CN)6]) Кислота железосинеродистая
- Йодид железа II,III (Fe3I8) Йодистое железо
- Йодид железа II (FeI2) Железо йодистое
- Карбонат железа II (FeCO3) Железо углекислое
- Лактат железа II (Fe(C3H5O3)2) Железо молочнокислое
- Лактат железа III (Fe(C3H5O3)3) Молочнокислое железо
- Метаванадат железа III (Fe(VO3)3) Ванадиевокислое железо
- Метагидроксид железа (FeO(OH)) Железо метагидроксид
- Молибдат железа II (FeMoO4) Железо молибденовокислое
- Нитрат железа II (Fe(NO3)2) Железо азотнокислое
- Нитрат железа III (Fe(NO3)3) Азотнокислое железо
- Нитрид дижелеза (Fe2N) Железо азотистое
- Оксалат железа II (FeC2O4) Железо щавелевокислое
- Оксид железа II (FeO) Оксид железа
- Оксид железа III (Fe2O3) Окись железа ( Железный сурик )
- Оксид железа II,III (Fe3O4) Закись-окись железа
- Оксихлорид железа (FeOCl) Оксид-хлорид железа
- Пентакарбонилжелезо ([Fe(CO)5]) Пентакарбонил железа
- Перхлорат железа II (Fe(ClO4)2) Железо хлорнокислое
- Пирофосфат железа III (Fe4(P2O7)3) Железо пирофосфорнокислое
- Пирофосфат железа III-натрия (FeNaP2O7) Фосфорнокислое железо-натрий
- Платинажелезо (FePt) Железоплатина
- Плутонийдижелезо (Fe2Pu) Плутонийдижелезо
- Празеодимдижелезо (Fe2Pr) Дижелезопразеодим
- Ржавчина
- Самарийдижелезо (Fe2Sm) Дижелезосамарий
- Самарийпентажелезо (Fe5Sm) Пентажелезосамарий
- Самарийтрижелезо (Fe3Sm) Трижелезосамарий
- Селенид железа II (FeSe) Селенистое железо
- Силикат железа II (FeSiO3) Железо кремнекислое
- Силицид дижелеза (Fe2Si) Кремнистое железо
- Силицид железа (FeSi)
- Соль Мора (FeSO4·(NH4)2SO4·6H2O) Сульфат аммония-железа II
- Станнид железа (FeSn)
- Станнид трижелеза (Fe3Sn)
- Сульфат железа (FeSO4) Железо сернокислое (Железный купорос)
- Сульфат железа II-калия (K2Fe(SO4)2) Сернокислое железо-калий
- Сульфат железа III (Fe2(SO4)3) Железо сернокислое III
- Сульфат железа III-аммония (NH4Fe(SO4)2·12H2O) Сернокислое железо-аммоний
- Сульфат железа III-калия (KFe(SO4)2) Сернокислое железо-калий
- Сульфид железа II,III (Fe3S4)
- Сульфид железа II (FeS)
- Сульфид железа II-меди II (CuFeS2)
- Сульфид железа III (Fe2S3)
- Сульфид железа III-калия (KFeS2) Сернистое железо-калий
- Сульфит железа II (FeSO3) Железо сернистокислое
- Танталат железа II (Fe(TaO3)2) Железо танталовокислое
- Тартрат железа II (FeC4H4O6) Железо виннокислое
- Теллурид железа II (FeTe) Железо теллуристое
- Теллурид железа III (Fe2Te3) Теллуристое железо
- Тетракарбонилдигидриджелезо (H2Fe(CO)4)
- Тетракарбонилжелезо (Fe(CO)4) Тетракарбонил железа
- Тиосульфат железа II (FeSO3S) Тиосернокислое железо
- Тиоцианат железа II (Fe(SCN)2) Железо роданистое
- Тиоцианат железа III (Fe(SCN)3) Тиоциановокислое железо
- Титанат железа II (FeTiO3) Титановокислое железо
- Триренийдижелезо (Fe2Re3) Дижелезотрирений
- Формиат железа III (Fe(CHO2)3) Железо муравьинокислое
- Фосфат железа II (Fe3(PO4)2) Железо фосфорнокислое
- Фосфат железа III (FePO4) Фосфорнокислое железо
- Фосфинат железа III (Fe(PH2O2)3) Железо фосфорноватистокислое ( гипофосфит железа )
- Фторид железа II (FeF2) Железо фтористое
- Фторид железа III (FeF3) Фтористое железо
- Хлорид железо II (FeCl2) Железо двухлористое
- Хлорид железа III (FeCl3) Железо треххлористое
- Хлорид железа II,III (Fe3Cl8) Хлористое железо II,III
- Хлорид железа III-калия (FeCl3•2KCl•H2O) Хлористое железо-калий
- Хромат железа III (Fe2(CrO4)3) Железо хромовокислое
- Хромит железа II (Fe(СrO2)2) тетраоксид железа-дихрома
- Цианид железа II (Fe(CN)2) Железо цианистое
- Цитрат железа II (FeC6H6O7) Железо лимоннокислое
- Цитрат железа III (FeC6H5O7) Лимоннокислое железо
- Цитрат железа III-аммония (Fe(NH4)3(C6H5O7)2) Лимоннокислое железо-аммоний
Источник
Мир химии
МОР (Mohr), Карл Фридрих
Карл Фридрих Мор – немецкий химик-аналитик и фармацевт. Родился в Кобленце. Окончил Гейдельбергский университет (доктор философии, 1831); изучал фармацию также в Бонне и Берлине (ученик Л. Гмелина и Г. Розе). В 1832-1857 гг. работал аптекарем в Кобленце, попутно занимаясь наукой. В 1857-1863 гг. руководил предприятием по производству минеральных удобрений, будучи одним из его совладельцев. После банкротства предприятия перешёл на преподавательскую работу в Боннском университете (с 1866 г. – профессор химии и фармации).
Основные исследования Мора относятся к аналитической химии. В своём руководстве по объёмному анализу «Учебник по химико-аналитическому методу титрования» (т. 1-2, 1855-1856) последовательно изложил различные методы титриметрического анализа и дал им теоретическое обоснование. Ввёл понятие нормальности раствора в современном понимании. Разработал метод определения серебра (метод Мора). Предложил (1852) двойной сульфат аммония и железа(II) (соль Мора), а также щавелевую кислоту как исходные вещества для приготовления стандартных расторов для установления титра. В 1873 описал капельные реакции на фильтровальной бумаге и стеклянных пластинках.
Усовершенствовал технику титриметрических измерений (1853), сконструировал бюретку, зажим, пипетку, весы.
СОЛЬ МОРА — искуственный аналог минерала морит, является двойной сернокислой солью закиси железа и аммония. Соль Мо́ра — неорганическое соединение, соль железа и аммония двойная сернокислая . Формула: Fe S O 4 ·( N H 4 ) 2 S O 4 ·6 H 2 O .
Английское название: Ammonium iron(II) sulfate
Происхождение названия: название дано в честь немецкого химика Карла Фридриха Мора.
Другие названия (синонимы): соль Мора, соль закиси железа и аммония двойная сернокислая .
Источник
Соль Мора
1. (NH4)2Fe(SO4)2 · 6H2O соль Мора. Построена из октадров [Fe(H2O)6] 2+ , тетраэдров NH4 + и SO4 2- . Система водородных связей между NH4 + и молекулами Н2О, входящими в координационнуй сферу железа, обуславливает устойчивость соли Мора к окислению.
§ 7.Свойства соединений М 3+ .
Fe 3+ (d 5 ) →Co 3+ (d 6 ) →Ni 3+ (d 7 )
1. Уменьшается устойчивость СО = + 3
3. Основные свойства: уменьшаются
4. Комплексные соединения. Гексацианоферраты Fe 2+ , Fe 3+ .
а).Магнитные: диамагнитен парамагнитен
б). Термодин. Куст. = 10 37 Куст. = 10 44
в). Хим. активность нет есть
яд
.е)
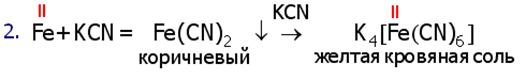
4.4.Качественная реакция на Fe(II)
Действие красной кровяной соли K3[Fe(CN)6] на Fe(II)
4.5. Качественная реакция на Fe(III)
Реально же структура турнбулевой сини и берлинской лазури одинакова. Различие в окраске обусловлено разным гидратным составом.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Самое популярное на сайте:
Оптимизм, скептицизм, агностицизм Общая характеристика неклассической теории познания Сегодня можно говорить о кризисе классической гносеологии.
Задания для закрепления. 1. К осмотровому и подъемно-транспортному оборудованию относятся: ____________ 1. К осмотровому и подъемно-транспортному оборудованию относятся.
Приготовление дез. растворов различной концентрации ДЕЗИНФЕКЦИЯ – это уничтожение вегетативных форм патогенных и непатогенных микроорганизмов на различных объектах оборудования.
Глобальная компьютерная сеть Internet Глобальные компьютерные сети Глобальная сеть — это протяженная коммуникационная сеть связи.
Техника проведения оксигенотерапии Показание: устранение гипоксии различного происхождения. Методы подачи кислорода можно разделить на ингаляционные.
Источник