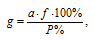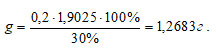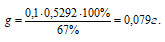Гравиметрическое определение вещества в навеске сплава алюминия и соли Мора
Гравиметрическое определение сульфата железа в навеске соли Мора
Задача 52.
Вычислить навеску исследуемого образца, необходимого для получения определенного количества весовой формы. Исследуемый образец: соль Мора; определяемое вещество FeSO4, приблизительное содержание 30 %; весовая форма Fe2O3, масса 0,2г.
Решение:
Расчёт навески вещества в пробе проводим по формуле:
где а — масса весовой формы определяемого вещества, г;
f- аналитический множитель (фактор пересчета);
a — масса навески, г;
Р — приблизительное процентное содержание вещества в образце.
Подставим все числовые значения в расчётную формулу:
Ответ: Для гравиметрического определения FeSO4 необходимо взвесить навеску соли Мора массой близкой к 1,27г.
Гравиметрическое определение алюминия в навеске его сплава
Задача 53.
Вычислить навеску исследуемого образца, необходимого для получения определенного количества весовой формы. Исследуемый образец: алюминиевый сплав; определяемое вещество Al, приблизительное содержание 67%; весовая форма Al2O3, масса 0,1г.
Решение:
Расчёт навески вещества в пробе проводим по формуле:
где а — масса весовой формы определяемого вещества, г;
f- аналитический множитель (фактор пересчета);
a — масса навески, г;
Р — приблизительное процентное содержание вещества в образце.
Ar(Al) = 26,98;
Mr(Аl2O3) = 101,96;
f = 2Ar(Al)/Mr(Аl2O3) = (2 . 26,98)/101,96 = 0,5292.
Подставим все числовые значения в расчётную формулу:
Ответ: Для гравиметрического определения алюминия необходимо взвесить навеску алюминиевого сплава массой близкой к 0,079г.
- Вы здесь:
- Главная
- Задачи
- Аналитическая химия
- Гравиметрический анализ соли Мора и алюминиевого сплава. Задачи 52 — 53
Источник
9.1 Расчеты массы навески вещества
NaClНАСЫЩЕННЫЙ, 36г NaCl растворяют в 100мл воды при 20°С.
NH4Cl (0.5N), m(1/1) = 0.5н*1л*(1\1)53,492г\моль = 26,746г (53,492г)
ZnCl2 (0.5N), m(1/2) = 0.5н*1л*(1\2)136,300г\моль = 34,075г (68,150г)
Al2(SO4)3 БЕЗВОД(0.5N), m(1/6) = 0.5н*1л*(1\6)342,15г\моль=28,5125г (57,025г)
Al2(SO4)3 *18H2O(0.5N),m(1/6) = 0.5н*1л*(1\6)666,43г\моль=55,536г (111,072г)
Навеску сульфата алюминия следует растворять маленькими порциями.
Гипсовая вода (насыщенный раствор CaSO4*0,5Н2О)
CaSO4•0,5Н2О (0.5N), m(1/2) = 0.5н*1л*(1\2)145,149г\моль= 36,287г (72,575г)
Если природный гипс CaSO4 • 2H20 нагревать при более высокой температуре, то выделяется вся вода. Образовавшийся безводный гипс CaSO4 уже не способен присоединять воду, и поэтому его назвали мертвым гипсом.
CoSO4 (0.5N), m(1/2) = 0.5н*1л*(1\2)155,00г\моль = 38,750г (77,500г)
CoSO4*7H2O (0.5N), m(1/2) = 0.5н*1л*(1\2)281,11г\моль = 70,276г (140,555г)
CuSO4*5H2O (0,2N), 16г CuSO4 растворяют в 1л воды.
CuSO4 (0.5N), m(1/2) = 0.5н*1л*(1\2)159,61г\моль = 39,903г (79,805г)
CuSO4*5H2O (0.5N), m(1/2) = 0.5н*1л*(1\2)249,69г\моль = 62,423г (124,845г)
CuSO4*5H2O (2N), 160г CuSO4 растворяют в 1л воды.
CuSO4НАСЫЩЕННЫЙ , нагревают CuSO4 в воде и добавляют CuSO4 до тех пор, пока порошок не перестанет растворяться.
FeSO4 (0.5N), m(1/2) = 0.5н*1л*(1\2)151,91г\моль = 37,977г (75,955г)
FeSO4*7H2O (0.5N), m(1/2) = 0.5н*1л*(1\2)278,010г\моль = 69,5025г (139,005г)
FeSO4 (1N), 27,8г FeSO4 развести в 1л воды. В готовый раствор добавить H2SO4КОНЦ до бледного цвета.
Раствор хранится относительно не долго, т.к. Fe 2+ окисляется под воздействием кислорода воздуха и переходит в Fe 3+ .
MgSO4 (0.5N), m(1/2) = 0.5н*1л*(1\2)120,37г\моль= 30,093г (60,185г)
MgSO4*7Н2О (0.5N), m(1/2) = 0.5н*1л*(1\2)246,48г\моль= 61,62г (123,24г)
Na2S (0.5N), m(1/2) = 0.5н*1л*(1/2)78,05г\моль= 19,513г (39,025г)
Na2S*9H2O (0.5N), m(1/2) = 0.5н*1л*(1/2)240,18г/моль = 60,045г (120,090г)
Если кристаллогидрат Na2S набрал воды, то раствор готовят на глаз или отмеряют массу в миллилитрах.
Na2S2O3*5H2O (0.5N), m(1/2) = 0.5н*1л*(1/2)248,18г/моль = 62,045г (124,60г)
Na2S2O3*5H2O (0.1N), m(1/2) = 0.1н*1л*(1/2)248,18г/моль = 12,409г (24,818г)
Na2SO3 (0.5N), m(1/2) = 0.5н*1л*(1\2)126,04г\моль= 31,51г (63,02г)
Na2SO3*7H2O (0.5N), m(1/2) = 0.5н*1л*(1\2)252,15г\моль= 63,038г (126,075г)
Na2SO4 (0.5N), m(1/2) = 0.5н*1л*(1\2)142,04г\моль = 35,51г (71,020г)
Na2SO4*10H2O(0.5N), m(1/2) = 0.5н*1л*(1\2)322,200г\моль= 80,550г (161,100г)
Навеску сульфата натрия следует растворять маленькими порциями.
NH4Fe(SO4)2*12H2O (0.5N),m=0.5н*1л*(1\3)482,20 г\моль= 80,366г (160,733г)
(NH4)2Fe(SO4)2*6H2O(0.5N),m = 0.5н*1л*(1\2)392,14 г\моль= 98,035г (196,07г)
После растворения соли Мора к полученному раствору добавляют не большое количество H2SO4КОНЦ до светло-зелёной окраски раствора.
(NH)2SO4 (0.5N), m(1/2) = 0.5н*1л*(1\2)132,14г\моль = 33,035г(66,070г)
NiSO4 (0.5N), m(1/2) = 0.5н*1л*(1\2)154,75г\моль = 38,687г (77,375г)
NiSO4*7H2O (0.5N), m(1/2) = 0.5н*1л*(1\2)280,86г\моль= 70,215г (140,430г)
ZnSO4 (0.5N), m(1/2) = 0.5н*1л*(1\2)161,45г\моль= 40,363г (80,725г)
ZnSO4*7Н2О (0.5N), m(1/2) = 0.5н*1л*(1\2)287,56г\моль= 71,89г (143,78г)
MgCO3 (0.5N), m(1/2) = 0.5н*1л*(1\2)84,314г\моль = 21,078г (42,157г)
NaНCO3 (0.5N), m(1/1) = 0.5н*1л*(1\1)84,007г\моль=42,004г (84,007г)
Раствор соды с хранением окисляется до Na2CO3!
Na2CO3 БЕЗВОД(0.5N), m(1/2) = 0.5н*1л*(1\2)105,989г\моль=26,497г (52,995г)
Na2CO3 *10H2O(0.5N), m(1/2) = 0.5н*1л*(1\2)286,142г\моль=71,536г (143,071г)
Na2CO3 (5%), 5г Na2CO3 растворяют в 95мл воды.
(NH4)2C2O4*H2O (0.5N), m(1/2)=0.5н*1л*(1\2)142,112г\моль =35,528г(71,056г)
K2CrO4 (0.5N) m(1/2) = 0.5н*1л*(1\2)194,19г\моль= 48,547г (97,095г)
K2Cr2O7 (0.5N) m(1/2) = 0.5н*1л*(1\2)294,19г/моль=147,095г (294,19г)
K2Cr2O7 (0.5N) m(1/6) = 0.5н*1л*(1\6)294,19г/моль=24,515г (49,031г)
K3[Fe(CN)6] (0.5N) m(1/3) = 0.5н*1л*(1\3)329,25г\моль=54,875г (109,75г)
K4[Fe(CN)6] (0.5N), m(1/2) = 0.5н*1л*(1\2 )368,35г\моль= 92,08г (184,175г)
K4[Fe(CN)6] 3H2O (0.5N), m(1/2) = 0.5н*1л*(1\2)422,39г\моль=70,39г (140,79г)
KBr (0.5N), m(1/1) = 0.5н*1л*(1\1)119,01г/моль = 59,505г (119,01г)
KI (0.5N), m(1/1) = 0.5н*1л*(1\1)166,002г/моль = 88,001г (166,002г)
КSCN (0.5N), m(1/1) = 0.5н*1л*(1/1)97,18г/моль = 48,590г (97,180г)
NH4SCN (0.5N), m(1/1) 0.5н*1л*(1\1)76,122г\моль = 38,061г (76,122г)
KIO3 (0.5N), m(1/6) = 0.5н*1л*(1\6)214,001г/моль = 17,833г (35,667г)
КМnO4 (0.5N), m(1/1) = 0.5н*1л*(1\5)158,036г/моль = 15,8036г (31,6072г)
Перманганат калия готовится заранее! За 8-10 суток до анализа, если раствор требуется срочно, то его кипятят 1-2 часа и фильтруют.
AgNO3 (0.5N), m(1/1) = 0.5н*1л*(1\1)169,874г/моль = 84,937г (169,874г)
Отходы серебра (отработанные растворы и осадки) собирают в специальный сосуд для регенерации серебра.
Bi(NO3)3 (0.5N), m(1/3) = 0.5н*1л*(1\3)394,995 г\моль = 65,833г (131,665г)
Bi(NO3)3*5H2O(0.5N), m(1/3) = 0.5н*1л*(1\3)485,072 г\моль=80,845г (161,691г)
КNO3 (0.5N), m(1/1) = 0.5н*1л*(1\1)101,103 г\моль = 50,552г (101,103г)
NaNO2 (0,5N), m(1/1)=0.5н*1л*(1\1)68,995г\моль= 34,498г (68,995г)
NaNO3 (0,5N), m(1/1)=0.5н*1л*(1\1)84,995г\моль= 42,498г (84,995г)
Pb(NO3)2 (0.5N), m(1/2) = 0.5н*1л*(1\2)331,2г\моль= 82,8г (165,6г)
Na2НРО4*12Н2О(0,5N),m(1/2)=0.5н*1л*(1\2)358,143г/моль=89,535г (179,072г)
Na3РО4*12Н2О(0,5N), m(1/3)=0.5н*1л*(1\3)380,124г/моль = 63,354г (126,708г)
СН3СООNa (0,5N), m(1/1) = 0.5н*1л*(1\1)82,0344г\моль=41,0172г(82,0344г)
(CH3COO)2Pb (0,1N), m(1/2) = 0.1н*1л*(1\2)325,3г\моль=16,265г (32,53г)
(CH3COO)2Pb (0,5N), m(1/2) = 0.5н*1л*(1\2)325,3г\моль=81,325г(162,65г)
(CH3COO)2Pb (2N), m(1/2) = 2н*1л*(1\2)325,3г\моль=325,3г (650,6г)
Методика приготовления растворов из фиксаналов
Ампула 1, в которой запаяно предназначенное для растворения вещество, имеет с двух концов по углублению, которые разбивают специальными бойками 2 – стеклянная палочка с острым концом и утолщением посредине. Перед тем как приготовить раствор, с ампулы снимают этикетку (если она есть) и промывают ее наружную поверхность дистиллированной водой. В мерную колбу 3 вместительностью 1000 мл вставьте воронку 4, а в нее – боек 2. Утолщение не позволяет бойку провалиться в колбу и одновременно препятствует попаданию в нее кусочков стекла разбитой ампулы. На боек в воронке поместите, придерживая рукой, ампулу. На верхний конец ампулы поставьте другой боек 2, придерживая его двумя свободными пальцами. Ударьте по верхнему бойку деревянным молоточком 5, чтобы пробить в ампуле сверху и снизу отверстия. Не изменяя положения ампулы и ничего не вынимая из воронки, ампулу изнутри промойте струей дистиллированной воды из колбы 6. Затем промойте, также стенки воронки и осколки стекла. Далее долейте в колбу воды до 2/3 ее вместимости, закройте пробкой и раствор перемешайте вращательными движениями. Долейте в колбу воды примерно на 1см ниже отметки 7, закройте колбу пробкой и перемешайте раствор, переворачивая ее вниз и вверх. Теперь по каплям долейте дистиллированную воду в колбу до метки и снова перемешайте содержимое_колбы. Если у вас была колба вместимостью 1000 мл, вы приготовили точно 0,1М раствор. Если же у вас была колба на 250 мл, то концентрация вашего раствора будет в 1000/250 = 4 раза больше, т. е. точно 0,4 моль/л. Если же вы воспользовались колбой на 100 мл, концентрация раствора будет равна точно 1 моль/л.
Источник