- Теория моря электронов Основы, свойства и недостатки
- Основы теории моря электронов
- свойства
- Оффшоринг в виде слоев
- Теория моря электронов в металлических кристаллах
- Недостатки теории
- ссылки
- Теория моря электронов: основы и свойства
- Основы теории электронного моря
- Характеристики
- Многослойный офшоринг
- Теория моря электронов в металлических кристаллах
- Недостатки теории
- использованная литература
Теория моря электронов Основы, свойства и недостатки
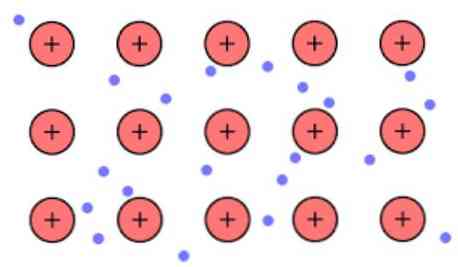
электронная теория электронов Это гипотеза, которая объясняет исключительное химическое явление, которое происходит в металлических связях между элементами с низкой электроотрицательностью. Речь идет о распределении электронов между различными атомами, связанными металлическими связями.
Электронная плотность между этими звеньями такова, что электроны делокализованы и образуют «море», в котором они свободно перемещаются. Это также можно выразить квантовой механикой: некоторые электроны (обычно от одного до семи на атом) расположены на орбиталях с несколькими центрами, которые растянуты по поверхности металла.
Кроме того, электроны сохраняют некоторое положение в металле, хотя распределение вероятностей электронного облака имеет более высокую плотность вокруг некоторых конкретных атомов. Это связано с тем, что при подаче определенного тока они показывают свою проводимость в определенном направлении.
- 1 Основы теории моря электронов
- 2 свойства
- 2.1 Смещение в виде слоев
- 2.2 Теория моря электронов в металлических кристаллах
Основы теории моря электронов
Металлические элементы имеют большую тенденцию жертвовать электроны с их последнего энергетического уровня (валентный слой), из-за их энергии ионизации, столь низкой по сравнению с другими элементами.
Зная это, каждый металлический элемент можно рассматривать как катион, связанный с электроном его последнего энергетического уровня, который был бы более склонным к пожертвованию.
Так как в металле у вас есть большое количество атомов, которые связаны друг с другом, вы можете предположить, что этот металл образует группу катионов металлов, которые погружены в своего рода море валентных электронов, которые имеют большое офшоринг.
Учитывая, что электростатические силы притяжения, которые существуют между катионом (положительный заряд) и электроном (отрицательный заряд), имеют сильно связанные атомы металла, он представляет делокализацию валентных электронов, которые ведут себя как электростатический адгезив, который сохраняет связь к катионам металла.
Таким образом, можно сделать вывод, что чем больше число электронов, присутствующих в валентном слое металла, этот тип электростатического клея будет иметь большую прочность.
свойства
Теория моря электронов предлагает простое объяснение характеристик металлических частиц, таких как сопротивление, проводимость, пластичность и пластичность, которые варьируются от одного металла к другому.
Было обнаружено, что сопротивление, оказываемое металлам, связано с большой делокализацией их электронов, которая генерирует очень высокую силу сцепления между атомами, которые его образуют..
Таким образом, пластичность известна как способность некоторых материалов допускать деформацию их структуры, не давая достаточно разрушаться при воздействии определенных сил..
Оффшоринг в виде слоев
Как пластичность, так и пластичность металла определяются тем фактом, что валентные электроны делокализованы во всех направлениях в виде слоев, что заставляет их двигаться друг над другом под действием внешней силы, избегая разрушения металлической структуры, но допуская ее деформацию.
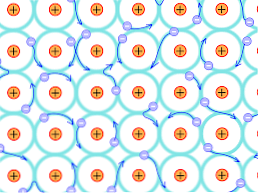
Аналогично, свобода движения делокализованных электронов позволяет проводить электрический ток, благодаря чему металлы имеют очень хорошую проводимость электричества..
Кроме того, это явление свободного движения электронов позволяет передавать кинетическую энергию между различными областями металла, что способствует передаче тепла и заставляет металлы проявлять высокую теплопроводность..
Теория моря электронов в металлических кристаллах
Кристаллы — это твердые вещества, которые имеют физические и химические свойства, такие как плотность, температура плавления и твердость, которые определяются теми силами, которые заставляют частицы удерживать их вместе..
В некотором смысле считается, что кристаллы металлического типа имеют простейшие структуры, поскольку каждая «точка» кристаллической сети занята атомом самого металла..
В этом же смысле было определено, что обычно структура металлических кристаллов является кубической и фокусируется на гранях или теле.
Однако эти виды также могут иметь шестиугольную форму и иметь достаточно компактную упаковку, что придает им ту огромную плотность, которая характерна.
По этой структурной причине связи, которые образуются в металлических кристаллах, отличаются от тех, которые возникают в других типах кристаллов. Электроны, которые могут образовывать связи, делокализованы по всей кристаллической структуре, как объяснено выше..
Недостатки теории
В металлических атомах имеется небольшое количество валентных электронов пропорционально их энергетическим уровням; то есть имеется большее количество доступных энергетических состояний, чем количество связанных электронов.
Это означает, что, поскольку существует сильная электронная делокализация, а также энергетические зоны, которые были частично заполнены, электроны могут перемещаться через ретикулярную структуру, когда они подвергаются воздействию электрического поля, поступающего извне, в дополнение к образованию океана электронов который поддерживает проницаемость сети.
Таким образом, объединение металлов интерпретируется как конгломерат положительно заряженных ионов, связанных с морем электронов (отрицательно заряженных).
Однако есть характеристики, которые не объясняются этой моделью, такие как образование определенных сплавов между металлами с определенным составом или стабильность коллективных металлических связей, среди других..
Эти недостатки объясняются квантовой механикой, потому что как эта теория, так и многие другие подходы были созданы на основе простейшей модели одиночного электрона, при попытке применить гораздо более сложные структуры многоэлектронных атомов..
ссылки
- Wikipedia. (2018). Wikipedia. Получено с en.wikipedia.org
- Холман Дж. С. и Стоун П. (2001). Химия. Получено из books.google.co.ve
- Паркин Г. (2010). Металл-Металл Склеивание. Получено из books.google.co.ve
- Rohrer, G.S. (2001). Структура и связь в кристаллических материалах. Получено из books.google.co.ve
- Ibach H. и Lüth H. (2009). Физика твердого тела: введение в основы материаловедения. Получено из books.google.co.ve
Источник
Теория моря электронов: основы и свойства
В теория электронного моря Это гипотеза, объясняющая исключительное химическое явление, возникающее в металлических связях между элементами с низкой электроотрицательностью. Это обмен электронами между разными атомами, связанными металлическими связями.
Плотность электронов между этими связями такова, что электроны делокализованы и образуют «море», в котором они свободно перемещаются. Это также можно выразить с помощью квантовой механики: некоторые электроны (обычно от одного до семи на атом) расположены на орбиталях с несколькими центрами, которые тянутся по поверхности металла.
Точно так же электроны сохраняют определенное место в металле, хотя распределение вероятностей электронного облака имеет более высокую плотность вокруг некоторых конкретных атомов. Это связано с тем, что при приложении определенного тока они проявляют свою проводимость в определенном направлении.
- 1 Основы теории электронного моря
- 2 свойства
- 2.1 Многослойный офшоринг
- 2.2 Теория моря электронов в металлических кристаллах
Основы теории электронного моря
Металлические элементы имеют большую тенденцию отдавать электроны со своего последнего энергетического уровня (валентной оболочки) из-за их низкой энергии ионизации по сравнению с другими элементами.
Зная это, каждый металлический элемент можно рассматривать как катион, связанный с электроном его последнего энергетического уровня, который с большей вероятностью будет жертвовать.
Поскольку металл имеет большое количество связанных вместе атомов, можно предположить, что указанный металл образует группу катионов металлов, которые погружены в своего рода море валентных электронов, которые имеют большую делокализацию.
Учитывая, что электростатические силы притяжения, существующие между катионом (положительный заряд) и электроном (отрицательный заряд), прочно связаны между собой атомами металла, он представляет, как делокализация валентных электронов ведет себя как электростатический клей, удерживающий их связанными с катионами металлов.
Таким образом, можно сделать вывод, что чем больше электронов присутствует в валентном слое металла, тем больше прочность такого электростатического клея.
Характеристики
Теория электронного моря предлагает простое объяснение характеристик металлических частиц, таких как сопротивление, проводимость, пластичность и пластичность, которые варьируются от одного металла к другому.
Было обнаружено, что сопротивление, оказываемое металлам, происходит из-за большой делокализации их электронов, которая создает очень высокую силу сцепления между атомами, которые их образуют.
Таким образом, пластичность известна как способность определенных материалов допускать деформацию своей структуры, не уступая достаточной для разрушения, когда они подвергаются определенным силам.
Многослойный офшоринг
И пластичность, и пластичность металла определяются тем фактом, что валентные электроны делокализованы во всех направлениях в виде слоев, что заставляет их перемещаться один поверх другого под действием внешней силы, избегая поломка металлической конструкции, но допускающая ее деформацию.
Точно так же свобода движения делокализованных электронов позволяет протекать электрическому току, благодаря чему металлы обладают очень хорошей проводимостью электричества.
Кроме того, это явление свободного движения электронов позволяет передавать кинетическую энергию между различными областями металла, что способствует передаче тепла и заставляет металлы проявлять большую теплопроводность.
Теория моря электронов в металлических кристаллах
Кристаллы — это твердые вещества, обладающие физическими и химическими свойствами, такими как плотность, температура плавления и твердость, которые определяются силами, которые заставляют частицы, из которых они состоят, удерживаться вместе.
В некотором смысле, кристаллы металлического типа считаются самыми простыми структурами, потому что каждая «точка» кристаллической решетки занята атомом самого металла.
В этом же смысле было определено, что обычно структура металлических кристаллов является кубической с центром на гранях или на теле.
Однако эти виды также могут иметь гексагональную форму и иметь довольно компактную упаковку, что придает им характерную для них огромную плотность.
По этой структурной причине связи, которые образуются в металлических кристаллах, отличаются от тех, которые возникают в других классах кристаллов. Электроны, которые могут образовывать связи, делокализованы по всей кристаллической структуре, как объяснено выше.
Недостатки теории
В металлических атомах имеется небольшое количество валентных электронов пропорционально их энергетическим уровням; то есть доступно большее количество энергетических состояний, чем количество связанных электронов.
Это означает, что, поскольку существует сильная электронная делокализация, а также энергетические зоны, которые были частично заполнены, электроны могут перемещаться через сетчатую структуру, когда они подвергаются электрическому полю, исходящему извне, в дополнение к образованию океана электронов. который поддерживает проницаемость сети.
Таким образом, объединение металлов интерпретируется как конгломерат положительно заряженных ионов, связанных морем электронов (отрицательно заряженных).
Однако есть характеристики, которые не объясняются этой моделью, такие как образование определенных сплавов между металлами с определенным составом или стабильность коллективных металлических связей, среди прочего.
Эти недостатки объясняются квантовой механикой, потому что и эта теория, и многие другие приближения были созданы на основе простейшей модели одиночного электрона, пытаясь применить ее в гораздо более сложных структурах многоэлектронных атомов.
использованная литература
- Википедия. (2018). Википедия. Восстановлено с en.wikipedia.org
- Холман, Дж. С., и Стоун, П. (2001). Химия. Восстановлено с books.google.co.ve
- Паркин, Г. (2010). Металл-металл. Восстановлено с books.google.co.ve
- Рорер, Г. С. (2001). Структура и связь в кристаллических материалах. Восстановлено с books.google.co.ve
- Ибах, Х., и Лют, Х. (2009). Физика твердого тела: Введение в основы материаловедения. Восстановлено с books.google.co.ve
Источник