9.1. Аргентометрия
Основными рабочими растворами аргентометрии являются растворы нитрата серебра, хлорида натрия и тиоцианата калия или аммония. Хранят раствор AgNO3 в склянках из темного стекла, так как на свету соли серебра неустойчивы. Точную концентрацию раствора AgNO3 обычно устанавливают по хлориду натрия.
Растворы NaCl KSCN (NH4SCN) готовят из перекристаллизованных препаратов. Точную концентрацию KSCN (или NH4SCN) устанавливают по титрованному раствору нитрата серебра.
Кривые титрования в аргентометрии строят обычно в координатах pAg – V, где pAg = — lg[Ag + ], V – объем титранта.
Рассчитаем, например, кривую титрования 100,0 мл 0,10 М раствора NaCl раствором 0,10 М AgNO3, принимая для простоты расчетов, что объем раствора при титровании не изменяется и разница между активностью и концентрацией ионов несущественна.
В водном растворе хлорид натрия диссоциирован нацело, поэтому концентрация хлорид-ионов в начальной точке кривой титрования, равна концентрации NaCl, т.е. 0,10 моль/л и рCl = 1,00.
Добавление 1,00 мл раствора AgNO3 к NaCl вызовет образование осадка AgCl и концентрация Cl – в растворе уменьшится. Равновесные концентрации ионов в растворе будут равны: [Ag + ] = x, [Cl – ] = 0/099 + x. В соответствии с правилом произведения растворимости [Ag + ] [Cl – ] = 1,78·10 -10 можно записать
х(х +0,099) = 1,78·10 -10 , откуда х = [Ag + ] = моль/л или
рAg = 8,74. Добавление 90,0 мл раствора AgNO3 свяжет примерно 90 % хлорида в осадок AgCl, и в растворе останутся равновесные концентрации [Ag + ] = х и [Cl – ] = 0,01 + х. Из ПРAgCl получаем: х = [Ag + ] = моль/л, что соответствует рAg = 6,74. После добавления 99,9 мл раствора AgNO3 в анализируемом растворе останется примерно 0,1 % взятого для титрования количества хлорида, т.е. в растворе будет [Ag + ] – х, [Cl — ] = 10 -4 + х и х = = 1,78·10 -6 моль/л, откуда рAg = 5,74. При добавлении 100,0 мл раствора AgNO3 достигается точка эквивалентности, в которой концентрации ионов Ag + и Сl — одинаковы:
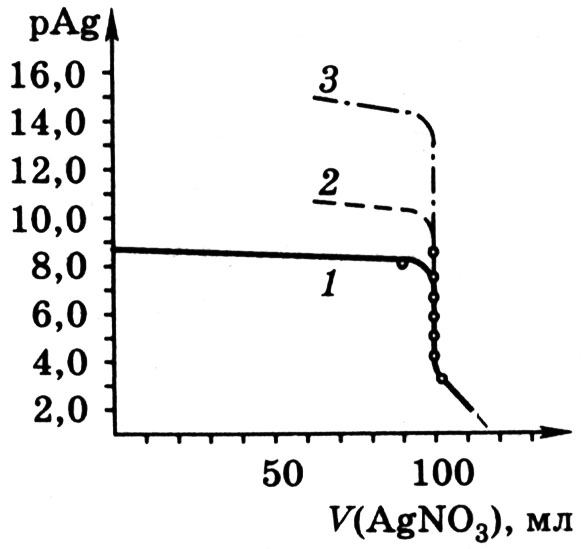
[Ag + ] =[Cl — ] = = 1,33·10 -5 моль/л, а рAg = 4,88. Избыток в 0,10 мл раствора AgNO3 сверх эквивалентного приводит к концентрации [Ag + ] =10 -4 +х и [Cl — ] = х, а так как х « 1,0·10 -4 , то [Ag + ] = 1,0·10 -4 моль/л, и рAg = 4,0. Избыток в 1,00 мл раствора AgNO3 дает [Ag + ] = 1,0·10 -3 моль/л и рAg = 3. Кривая аргентометрического титрования представлена на рис. 9.1.
Рис. 9.1. Кривые аргентометрического титрования
Как показывает рисунок кривая сохраняет традиционный вид. Сначала от первых капель до оттитровывания 90 % имеющегося хлорида рAg изменяется всего на одну единицу, затем то же изменение рAg вызывает только 9,0 мл раствора AgNO3, а в области точки эквивалентности наблюдается скачок титрования. Добавление 0,2 мл раствора AgNO3 в этой области (от 99,9 до 100,1 мл) вызывает изменение рAg от 5,74 до 4,00, т.е. почти на две единицы. Величина скачка титрования возрастает с увеличением концентрации реагирующих веществ и с уменьшением температуры, так как понижение температуры вызывает уменьшение ПР. Зависимость величины скачка титрования от ПР можно проследить, если рассчитать область скачка титрования для реакции взаимодействия AgNO3 с бромидом и иодидом натрия. С уменьшением ПР соли серебра, образующейся при титровании, увеличивается скачок титрования (рис. 9.1).
Установление точки эквивалентности в аргентометрии осуществляется как с помощью индикаторов, так и без них, следующими методами.
1. Метод равного помутнения
Метод равного помутнения предложен Гей-Люссаком и характеризуется высокой точностью. При титровании, например, хлорида натрия нитратом серебра вблизи точки эквивалентности отбирают небольшие порции прозрачного раствора и добавляют к одной порции AgNO3, а к другой NaCl. Если точка эквивалентности достигнута, то помутнение в обеих порциях будет одинаковым. В недотитрованных растворах помутнение будет происходить только при добавлении AgNO3, а в перетитрованных – при добавлении NaCl.
2. Метод Мора (индикатор – хромат калия)
Идея метода основана на образовании кирпично-красного осадка хромата серебра Ag2CrO4 в точке конца титрования. При аргентометрическом титровании хлорида концентрация ионов в точке эквивалентности составляет
[Ag + ] =[Cl — ] = = = 1,33·10 -5 моль/л. Концентрация ионов CrO4 2– , необходимая для достижения , при этой концентрации ионов Ag + составляет [CrO4 2– ] = моль/л, однако при этой концентрации осадок хромата серебра «на глаз» не будет заменен. Для визуального обнаружения осадка хромата серебра обычно бывает достаточно перетитровать анализируемый раствор на одну каплю раствора AgNO3.
Титрование с хроматом калия в качестве индикатора проводится в нейтральной или слабощелочной среде, когда рН раствора больше 6,5, но меньше 10,5. В более кислой области происходит протонирование хромата (CrO4 2– + H + = HCrO4 – ) и чувствительность индикатора падает, а при рН > 10,5 оксид или гидроксид серебра может выпадать ранее хромата.
Метод Мора обычно применяют для определения хлоридов и бромидов. Иодиды и тиоцианаты так не определяются, в связи с тем, что вследствие адсорбции установление точки эквивалентности становится затруднительным и погрешность анализа существенно возрастает.
3. Метод Фольгарда [индикатор – тиоцианатные комплексы железа (III)]
Реакцию взаимодействия серебра с тиоцианатом используют для определения галогенидов методом обратного титрования. По этому методу к анализируемому раствору галогенида (хлорида или бромида) добавляют избыток титрованного раствора AgNO3 и не вошедшее в реакцию количество Ag + оттитровывают тиоцианатом калия или аммония в присутствии ионов Fe 3+ .
Тиоцианатная реакция железа позволяет обнаружить в растворе тиоционат при концентрации порядка 10 -5 моль/л, что соответствует 0,01 мл 0,1 М KSCN в 100,0 мл раствора.
В точке эквивалентности [Ag + ] =[SCN – ] = = 1,05·10 –6 . При этой концентрации тиоцианата окрашивание раствора не происходит. Первая же избыточная капля тиоцианата калия (аммония) вызывает четкую оранжевую окраску.
По методу Фольгарда можно оттитровать и другие анионы, образующие малорастворимые соединения с ионами Ag + (CrO4 2- , PO4 3- и др.). Достоинством метода Фольгарда является возможность определения галогенидов в кислой среде.
4. Метод Фаянса (адсорбционные индикаторы)
Адсорбционными индикаторами называют соединения, которые при адсорбции на осадке изменяют свой цвет. Установлено, что в первую очередь на осадке адсорбируются ионы, одноименные с осадком. Например, при титровании хлорида нитратом серебра на осадке AgCl до точки эквивалентности будут адсорбироваться преимущественно ионы Cl – и для нейтрализации отрицательного заряда к частицам осадка будут притягиваться положительно заряженные ионы из раствора. После точки эквивалентности адсорбироваться на осадке будут избыточные ионы Ag + и для нейтрализации положительного заряда осадка из раствора будут притягиваться отрицательно заряженные ионы, в том числе анионы индикатора. Анионы некоторых красителей, адсорбируясь, изменяют свой цвет. Так, флуоресцин, применяемый при титровании хлоридов, в растворе имеет желто-зеленую окраску, а в точке эквивалентности окрашивает осадок AgCl в красный цвет. Для титрования бромидов, иодидов и тиоцианатов используют эозин: в точке эквивалентности окраска из желтой становится розовой.
Метод Фаянса имеет менее широкое применение, чем методы Мора и Фольгарда.
Источник
Б. Титрование по методу Мора
Определение конечной точки титрования при аргентометрическом титровании хлорид-ионов по методу Мора основано на применении индикатора К2СrО4. Вблизи точки эквивалентности наблюдается начало образования кирпично-красного осадка хромата серебра, что ведет к изменению цвета осадка.
Заранее рассчитайте, какой объем индикатора К2СrО4 в виде 0,5 М раствора надо вводить на каждые 100 мл титруемого раствора, чтобы начало образования осадка Аg2CrO4 наблюдалось при рАg=5,0, т.е. совпадало бы с точкой эквивалентности при титровании хлоридов. Укажите в отчете, можно ли титровать по Мору другие галогениды. Подтвердите свою точку зрения расчетами. Какие посторонние ионы помешают аргентометрическому титрованию вообще и по методу Мора в частности? Какой может быть кислотность раствора в ходе титрования и почему?
1. В коническую колбу для титрования введите аликвоту раствора NaCl (10,0 или 5,0 мл), разбавьте водой до 50-100 мл, введите рассчитанный объем индикатора и оттитруйте стандартизованным раствором AgNOз до неисчезающей розово-кирпичной окраски взвеси. Для подавления адсорбции ионов на осадке полезно прибавить 1-2 мл ССl4или другого тяжелого органического растворителя, не смешивающегося с водой.
2. По среднему результату двух титрований рассчитайте молярную концентрацию хлорида натрия в растворе, а затем пересчитайте ее на процентную.
В. Титрование по методу Фаянса
Ознакомьтесь с принципом действия адсорбционных индикаторов по учебникам. Какие преимущества имеет метод Фаянса по сравнению с методом Мора (и наоборот)? Сравните перечни мешающих веществ, круг определяемых веществ, допустимые значения рН титруемого раствора и т.п.
1. В небольшую коническую колбу введите аликвоту раствора NaCl, концентрацию которого определяли в предыдущей части работы, и оттитруйте с адсорбционным индикатором флуоресцеином. Особенно важен темп титрования вблизи точки эквивалентности (медленно!), нежелательно яркое освещение. Титрование можно провести, взяв вместо хлорида бромид, при этом следует использовать другой адсорбционный индикатор — эозин. Переход окраски осадка в этом случае — от желто-розовой к светло-фиолетовой. Обратите внимание на коагуляцию осадка вблизи точки эквивалентности.
2. Рассчитайте молярную концентрацию растворов NaCl или KВr по среднему значению Vк.т.т из двух титрований.
Г. Титрование по методу Фольгарда
Ознакомьтесь с методикой обратного титрования галогенид-ионов по Фольгарду. Какие преимущества имеет этот способ титрования по сравнению с другими?
При определении хлоридов по Фольгарду следует позаботиться о предотвращении побочной реакции — растворения осадка AgCl в ходе титрования избыточного серебра роданидом. С этой целью осадок отфильтровывают или вводят немного ССl4,затрудняющего растворение осадка. При определении иодидов или бромидов такая предосторожность не требуется (почему?)
1. К аликвоте (10,00 мл) анализируемого, примерно 0,1 М раствора KI, добавьте 1-2 мл 2 н. раствора азотной кислоты, разведите водой, а затем из бюретки или мерной пипетки введите определенный, заранее рассчитанный объем рабочего раствора AgNOз, чтобы ионы серебра оказались в некотором избытке. Введите в полученную взвесь 1-2 мл раствора индикатора (железоаммонийных квасцов) и осторожно оттитруйте избыток серебра роданидом. Титрование повторить. Можно ли вводить индикатор еще до прибавления AgNOз ?
2. Расчет результатов обратного титрования проводится по формуле:
Источник