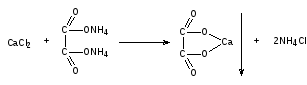
- Применение
- Соединения кальция
- Получение
- Описание и растворимость
- Подлинность
- Чистота
- Количественное определение
- Метод Мора
- Определение хлоридов методом Мора
- Опредление подлинности
- Количественное определение
- Опредление подлинности
- Количественное определение
- Опредление подлинности
- Количественное определение
- Опредление подлинности
Применение
Магния оксид – антацидное средство с легким послабляющим эффектом.
Магния сульфат – спазмолитическое, противосудорожное, успокаивающее, желчегонное и слабительное средство.
Соединения кальция
CаCI2 6H2O
Субстанция; раствор для инъекций 10%
Кальция сульфат жженый
CaSO4 0,5H2O
Получение
Кальция хлорид получают из природного минерала – кальцита:
Сопутствующие примеси (соли железа и магния) осаждают раствором кальция гидроксида:
Осадки железа и магния гидроксидов отфильтровывают.
Избыток кальция гидроксида нейтрализуют кислотой хлороводородной разведенной:
Кальция сульфат жженый получают из природного минерала – гипса дигидрата (CaSO4 2H2O). При нагревании до 150 0 С гипс природный теряет часть кристаллизационной воды и превращается в гипс медицинский:
Описание и растворимость
Кальция хлорид – белый кристаллический порошок или бесцветные прозрачные кристаллы, без запаха, горько-соленого вкуса, очень гигроскопичен, расплывается на воздухе. Легко растворим в воде и спирте.
Кальция сульфат жженый – белый аморфный порошок, мало растворим в воде (1:600).
Подлинность
1. Доказательство катиона кальция (Са 2+ ).
1.1. Соль кальция окрашивает бесцветное пламя в кирпично-красный цвет.
1.2. Реакция осаждения аммония оксалатом:
Образуется белый осадок кальция оксалата, растворимый в разведенных минеральных кислотах и нерастворимый в кислоте уксусной и растворе аммиака.
2. Реакция на хлорид-ион (см. с. 25).
3. Реакция на сульфат-ион (см. с. 44).
Чистота
При определении доброкачественности кальция хлорида определяют:
1. Прозрачность и цветность водных растворов.
2. Предел кислотности или щелочности.
3. Отсутствие или предельное содержание общих примесей, солей бария, магния, железа, алюминия, фосфатов и др. с помощью химических реакций.
При определении доброкачественности кальция сульфата жженого определяют его способность к затвердеванию: смешивают 10 г гипса и 5 мл воды. Время затвердевания должно быть 4-5 минут.
Количественное определение
1. Комплексонометрический метод (вариант прямого титрования). Метод основан на свойстве ионов кальция образовывать с трилоном Б прочные, бесцветные, растворимые в воде комплексные соединения.
Титрант – раствор трилона Б.
Индикация – 2 варианта:
а) индикатор – хромовый темно-синий; среда – аммиачный буфер с рН 9,5-10,0. Переход окраски от красной к сине-фиолетовой.
б) индикатор – кальконкарбоновая кислота; рН среды в конце титрования 12-14. Создается добавлением 30% раствора натрия гидроксида. Переход окраски от розовой к синей.
2. Аргентометрический метод (вариант Мора). Основан на количественном осаждении хлорид-ионов серебра нитратом. Индикатор – калия хромат.
3. Меркуриметрический метод. Основан на свойстве хлорид-ионов количественно взаимодействовать с солями ртути (II) с образованием трудноионизированных соединений.
Титрант – легко ионизированные соли ртути (II): Hg(NO3)2, Hg(CIO4)2.
Среда – азотнокислая. Индикатор – дифенилкарбазон.
Количественное определение кальция сульфата жженого не проводят.
Источник
Метод Мора
Метод Мора является одним из аргентометрических методов. Все эти методы основаны на реакции:
Метод Мора является наиболее простым из всех методов аргентометрии и в то же время достаточно точным. Титрантом является раствор нитрата серебра АgNОз 0.1 моль/л.
В основу метода Мора положена реакция взаимодействия ионов серебра с С1 — или Вг — .
Индикатором является хромат калия К2СгО4 5 %. Установочным веществом для определения титра раствора является NаС1 или КС1 0.1 моль/л.
Метод Мора позволяет определить количество хлоридов или бромидов. Иодиды этим методом не определяют, так как выпадающий в осадок иодид серебра АgI сильно адсорбирует К2СгО4, поэтому точку эквивалентности определить невозможно.
Растворимость АgСl значительно меньше, чем растворимость Аg2СгO4. Поэтому если постепенно добавлять раствор АgNOз к раствору, содержащему Сl — и CrO4 2- , то ПРAgС| достигается раньше ПР Аg2СгO4.
Это означает, что вначале образуется труднорастворимая соль
После того как хлорид-ионы будут практически полностью выделены в виде АgС1, появляется осадок. Происходит изменение окраски титруемой смеси и таким образом определяется конец титрования.
При титровании раствора бромида происходит аналогичное явление. Так как ПРАgВг < ПРАg2СгO4.,то вначале происходит образование АgВг и только после полного выделения АgВг появляется осадок Аg2СгО4, меняющий окраску титруемой смеси. Осадок хромата серебра Аg2СгО4 имеет кирпично- красный цвет. Однако такой цвет можно наблюдать в сильно перетитрованном растворе. В действительности надо титровать только до ясно заметного перехода лимонно-желтой окраски в желто — розовую. Для лучшего определения конца титрования можно использовать раствор «свидетель».
Применение метода Мора ограничено следующими условиями:
1. Определение можно проводить только в нейтральной среде, так как в кислой среде хромат серебра растворяется, и мы не сможем заметить конец титрования. В щелочной среде титрование невозможно потому, что будет выпадать осадок оксида серебра:
2. Определение нельзя проводить в присутствии ионов Ва 2+ , Вi 3+ , Рb 2+ , так как эти ионы образуют с ионами СгО4 2 — осадки.
3. Титрование всегда ведут от галогенида к АgNOз (т. е. галогенид титруют раствором АgNОз, а не наоборот). Только при таком условии кирпично-красный осадок Аg2СгО4 образуется в точке эквивалентности.
Метод Мора находит широкое применение при анализе пищевых продуктов. Количество поваренной соли в колбасе, соленой рыбе, масле и других продуктах определяют по методу Мора.
Этот метод применяется также для определения хлоридов в воде. Метод Мора используется и при анализе некоторых фармацевтических препаратов, например хлоридов и бромидов натрия и калия.
Определение хлоридов методом Мора
Приготовление титранта 0.05 моль/л раствора. Нитрат серебра не относится к тем веществам, из которых можно приготовить раствор заданной концентрации по точно взятой навеске. Поэтому готовят раствор примерно требуемой концентрации, а его титр устанавливают. Необходимую навеску (8.5 г AgNОз на 1 л раствора) отвешивают с точностью до 0.1 г на технических весах, и нужное количество воды отмеривают мерным цилиндром. Раствор сохраняют в темноте, так как на свету нитрат серебра разлагается. Однако и при надлежащем хранении титр раствора АgNОз меняется с течением времени и его необходимо время от времени проверять.
Приготовление установочного раствора. Для приготовления 0.05 моль/л, раствора NаС1 отвешивают на аналитических весах 0.2922 г NаС1 и количественно переносят в мерную колбу вместимостью 100 мл. Растворяют навеску в дистиллированной воде, доводят раствор до метки и хорошо перемешивают. Таким образом получают раствор NаС1.
Определение титра нитрата серебра. В качестве индикатора применяют 5 % раствор хромата калия К2СгО4 в воде. Наполняют бюретку раствором нитрата серебра АgNОз. Отобрав пипеткой 10 мл 0.05 моль/л раствора NаС1, переносят ее в колбу Эрленмейера вместимостью 250 мл, добавляют 0.5 мл раствора индикатора, немного разбавляют водой и медленно титруют 0.1 моль/л раствором АgNОз, непрерывно перемешивая жидкость до появления первого неисчезающего изменения цвета суспензии. Нужно уловить момент, когда лимонно-желтый цвет суспензии приобретет от капли АgNОз слегка красноватый оттенок. Запись анализа и расчеты производят так же, как при определениях кислотно-основным методом.
Определение хлорида в растворе. Раствор хлорида помещают в мерную колбу на 100 мл, доводят дистиллированной водой до метки и перемешивают. Для титрования отбирают в коническую колбу 10 мл полученного раствора, немного разбавляют водой, добавляют 0.5 мл раствора К2СгO4 и титруют раствором АgNОз до изменения окраски содержимого колбы из лимонно-желтой в желто-розовую. Рассчитывают содержание хлора в полученном растворе (в граммах).
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
Опредление подлинности
Кальций-ион. К 1 мл ЛФ прибавляют по 2 капли гидроксида аммония и хлорида аммония, 4 капли раствора аммония оксалата. Образуется белый осадок, растворимый в разведенных минеральных кислотах.
Количественное определение
Кальция хлорид (трилонометрически). Метод основан на образовании устойчивого комплекса Трилона Б с ионами Ca 2+ .
К 0,5 мл ЛФ прибавляют 1 мл аммиачного буферного раствора, 1 каплю раствора кислотного хром черного специального и титруют 0,05 моль/л раствором Трилона Б до синего окрашивания.
(Dотн=0).
Заключение: Данная лекарственная форма приготовлена удовлетворительно.
- Проверка на подлинность порошка норсульфазола
Norsulfazolum –Норсульфазол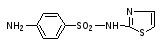
- 0,1 г препарата растворяют в 1 мл разведенной соляной кислоты и прибавляют 1 мл 0,1 моль/л раствора нитрита натрия; 1мл полученного раствора приливают к 1мл щелочного раствора β-нафтола. Появляется вишнево-красное окрашивание.
- 0,1 г препарата взбалтывают с 3 мл 0,1 моль/л раствора натрия гидроксида в течение 2мин и фильтруют; к фильтрату прибавляют 1 мл раствора меди сульфата; образуется осадок грязно-фиолетового цвета.

- Rp: Sol. Euphyllini 1% – 1000 ml
См. Rp №11. Заключение: Данная лекарственная форма приготовлена удовлетворительно.
- Rp: Sol. Calcii chloridi 2% – 100 ml
Описание: Бесцветная, прозрачная жидкость, без запаха и механических примесей. Общий объем 100 мл.
Опредление подлинности
Количественное определение
Кальция хлорид (Рефрактометрически). Обоснование метода и методику См Rp №13. 

- Rp: Sol. Ac. borici 2% – 70 ml
Описание: Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 70 мл.
Опредление подлинности
Кислота борная. Выпаривают 5 капель раствора на водяной бане. К сухому остатку прибавляют 2 мл 96% этанола и поджигают. Наблюдают пламя с зеленой каймой.
Количественное определение
Кислота борная (методом нейтрализации). Метод основан на реакции нейтрализации борной кислоты раствором натрия гидроксида. К 0,5 мл раствора прибавляют 1 каплю фенолфталеина, 1 мл глицерина, титруют 0,1 моль/л раствором натрия гидроксида. 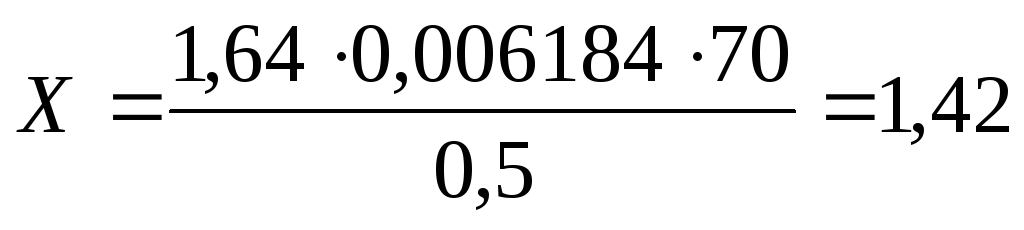

- Rp: Dimedroli 0,12
Zinci sulfatis 0,15 Sol. Ac. borici 2% ad 60 ml Описание: Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 60 мл.
Опредление подлинности
Кислота борная. См. Rp № 23. Димедрол. См. Rp №17. Цинка сульфат. К 0,5 мл раствора прибавляют 2 капли раствора калия ферроцианида. Образуется белый студенистый осадок, нерастворимый в разведенной соляной кислоте.
Источник