сущность метода мора
Метод Мора является одним из аргентометрических методов. Все эти методы основаны на реакции:
Ag+ + X- = AgX|, где Х- — ионы С1-, Bi~, I» CNS-.
Метод Мора наиболее простой из всех методов аргентометрии и в то же время достаточно точный. Рабочим раствором в этом методе является раствор нитрата серебра AgN03.
В основу метода Мора положена реакция взаимодействия ионов серебра с ионами хлора или брома:
Agt + Cl-^AgCll, Ag+ + Br = AgBr J.
Индикатором является раствор хромата калия КгСг04, дающий с ионами серебра красно-бурый осадок хромата серебра Ag2Cr04. Исходным веществом для определения титра рабочего раствора является хлорид натрия NaCl или хлорид калия КС1.
Метод Мора позволяет определять количество хлоридов или бромидов, йодиды этим методом не определяют, так как выпадающий в осадок йодид серебра.
Применение метода Мора ограничено следующими условиями.
1. Определение можно проводить только в нейтральной среде, так как в кислотах хромат серебра растворяется, и мы не сможем заметить конец титрования. В щелочной среде титрование невозможно
потому, что будет выпадать осадок оксида серебра
Определение нельзя проводить в присутствии ионов Ва2+, Bi3+, Pb2+, так как эти ионы образуют с ионами Сг042_ осадки, а также в присутствии анионов, дающих труднорастворимые осадки с Ag+ (РОГ, СО! » и Др.) .
Титрование всегда ведут от галогена к AgN03 (т. е. галоген титруют раствором AgN03, а не наоборот) , только при таком условии кирпично-красный осадок Ag2Cr04 образуется в точке эквивалентности.
Метод Мора широко применяется при анализе пищевых продуктов. Количество поваренной соли в колбасе, соленой рыбе, масле и других продуктах определяют аргентометрически по методу Мора. Этот метод применяется также для определения хлоридов в воде.
Источник
Количественное определение аргентометрия
Аргентометрический метод основан на свойстве галогенид-ионов количественно осаждаться серебра нитратом с образованием галогенидов серебра.
MeHal + AgNO3 → AgHal↓+ MeNO3 F
- величина рН. Адсорбционные индикаторы являются слабыми протолитами, поэтому титрование при определенном значении рН в уксуснокислой среде
- концентрация раствора. С ↑ площади поверхности осадка — ↑ количество адсорбированных молекул индикатора и более резкое изменение окраски в т.э. При увеличении концентрации иодид-ионов в растворе повышается точность.
- посторонние ионы. Адсорбционные индикаторы чувствительны к значению ионизации посторонних ионов в растворе. Это учитывается при определении йодидов в многокомпонентных смесях.
Вариант Фаянса может быть применен для определения хлоридов и бромидов. В качестве индикаторов используются бромфеноловый синий или флуоресцеин. Используют для определения НCI и НBr азотистых оснований (новокаин — прокаин). 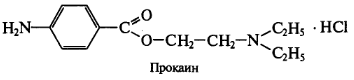




Для продолжения скачивания необходимо пройти капчу:
Источник
Метод Мора
Метод основан на том, что галиды (хлориды, бромиды, иодиды) с ионом серебра дают практически нерастворимый галид серебра, выпадающий в осадок. Рабочий титрованный раствор — раствор AgNO3. Для определения конца реакции пользуются хроматом калия К2Сг04. В этом случае протекают две реакции:
Обе получающиеся соли — AgCl и Ag2Cr04 — трудно растворы в воде, но при добавлении AgNO3 к раствору, содержащему, кроме ионов Сl — , также ионы СlO4 2- первоначально образуется AgCl и только потом, когда ионы Сl — практически полностью будут удалены из раствора, начинается образование Ag2CrO4. В этот момент цвет осадка начнет изменяться: из белого или желтого он будет переходить в [красноватый, по появлению которого и судят о том, что реакция между ионами Сl — и Ag + закончилась. Такая последовательность образования осадков зависит от того, что AgCl менее растворим (1,25-10 г-экв/л), чем Ag2Cr04 (0,65-10 г-экв/л), и потому осаждается из раствора первым.
Применение метода Мора ограничено: точные результаты получаются только в нейтральной среде. В минеральных кислотах Ag2Cr04 растворяется и в их Присутствии выпадать не может. В присутствии щелочей метод Мора также не применим, так как в таких растворах ионы ОН — дают с ионами Ag + бурый осадок Ag2O, который образуется вследствие распада получающейся неустойчивой гидрида серебра:
В аммиачной среде осадки AgCl и Ag2Cr04 растворяются, что обусловлено образованием комплексных аммиачно-серебряных солей. Не применим этот метод также в присутствии ионов Ba 2+ , Pb 2+ и всех остальных ионов, которые дают не растворимые в воде осадки с ионами CrO4 2- .
Титрование по Мору следует производить при комнатной температуре, так как с повышением температуры увеличивается произведение растворимости Ag2CrO4 2- ; вследствие этого уменьшается чувствительность индикатора к иону Ag + .
Метод Фольгарда
Метод основан на образовании не растворимого в воде роданида серебра AgCNS, имеющего белый цвет. В качестве рабочих титрованных растворов применяют раствор нитрата серебра AgNO3 и раствор роданида калия КCNS или аммония NН4CNS, применимым в нейтральной и кислой среде. Наличие в растворе свободной кислоты дает более точный результат. Конец осаждения определяют индикаторами. В качестве индикатора применяют железо – аммиачные квасцы NН4Fe(SO4)2∙12H2O, которые в виде насыщенного раствора прибавляются к титруемой жидкости. Протекает реакция:
Как только реакция между ионами Ag и CNS заканчивается, следующая капля роданида калия вызывает образование роданида железа, который окрашивает жидкость в красный цвет
Для приготовления железо-аммиачных квасцов, нагревают насыщенный раствор, дают раствору охладится, затем фильтруют. К профильтрованной жидкости прибавляют концентрированную азотную кислоту до тех пор , пока она не станет бесцветной.
Лабораторная работа
Опыт 1 . Определение хлорида натрия по Мору.
Выполнение работы. На аналитических весах точно отвесить 1,4598г хлорида натрия (на 250 мл воды). Навеску перенести в мерную колбу растворить навеску в дистиллированной воде и довести до 250 мл. Отмерить пипеткой 20мл приготовленного раствора, прибавить 0,5 мл 5% раствора КCr04 и титровать из бюретки рабочим раствором AgNO3. По результатам титрования вычислить процентное содержание соли в пробе.
Определить нормальность приготовленного раствора хлорида натрия:
Содержание в навеске определяем по формуле:
Опыт 2. Определение хлорида натрия по Фольгарду
Выполнение работы. На аналитических весах точно отвесить навеску NaCl (m1=0,5798г) таким образом, чтобы получился 0,1н раствор. Из приготовленного раствора взять 25 мл, перенести в коническую колбу на 200мл и прилить из бюретки точно отмеренный объем титрованного раствора AgNO3. Объем раствора АgNO3 должен быть в 2 раза больше, чем нужно для полного осаждения ионов Cl — . Образуется осадок AgCl, а некоторая часть AgNO3 остается в свободном состоянии. Колбу с мутной жидкостью сильно встряхивают до тех пор пока AgCl не свернется, образуя комки и не осядет на дно. Жидкость становится прозрачной. Прибавляют 2-3 мл железо –аммиачных квасцов и оттитровывают избыток нитрата серебра NН4CNS до появления красноватого окрашивания не исчезающего при сильном взбалтывании. Расчет проводят по формулам. V1 AgNO3–объем прилитого раствора AgNO3
Источник