- Фонтан опыт по химии
- Фонтан опыт по химии
- Родителям и ученикам
- Фонтан опыт по химии
- Родителям и ученикам
- Аммиачный фонтан
- Проведите этот опыт с нашей подпиской!
- Реагенты
- Безопасность
- Часто задаваемые вопросы
- Фонтан не получился. В чём дело?
- Другие эксперименты
- Пошаговая инструкция
- Ожидаемый результат
- Утилизация
- Что произошло
- Как образуется аммиак?
- Дополнение
- Почему вода начинает поступать в колбу?
- Дополнение
- Почему аммиак хорошо растворяется в воде?
- Дополнение
- Почему так важно не переворачивать колбу?
- Дополнение
- Почему жидкость меняет свой цвет?
- Это интересно
- C какими другими газами можно сделать подобный фонтанчик?
Фонтан опыт по химии
Представьте себе такую картину: большая пустая колба закрыта пробкой с трубкой. На ваших глазах эту колбу переворачивают вверх дном и опускают в большой сосуд с водой. И тут неожиданно внутри колбы начинает бить сильный фонтан. Менее чем за минуту колба почти полностью заполняется водой.
Оказывается, в этом опыте нет ничего сложного. Его можно без особых усилий повторить самому. Для начала нам понадобятся: круглодонная колба на 0.5-1 л, пробка и пару трубок. Одна из трубок должна иметь оттянутый конец. Вариантов описанного эксперимента несколько, мы рассмотрим только два из них.
Опыт основан на очень хорошей растворимости хлористого водорода в воде.
Возьмите литровую колбу и подберите к ней хорошую резиновую пробку. В пробке делают два отверстия, через которые вставляют стеклянные трубки. Одна из них длинная с оттянутым концом, другая — короткая (рис. 1а). Диаметр отверстия в оттянутой трубке — 1-2 мм. Также подготовьте большой стеклянный кристаллизатор или любую другую прозрачную емкость на 2-3 л. Желательно, чтобы она была низкой.
В нашем опыте была использована колба со шлифом и насадка, которой обычно накрывают колбы-приемники при перегонке (рис. 1b). Это не принципиально, однако такая процедура избавила нас от необходимости сверлить отверстия в толстой резиновой пробке. В любом случае важно, чтобы пробка была вставлена в колбу плотно и герметично, иначе можно испортить весь опыт.
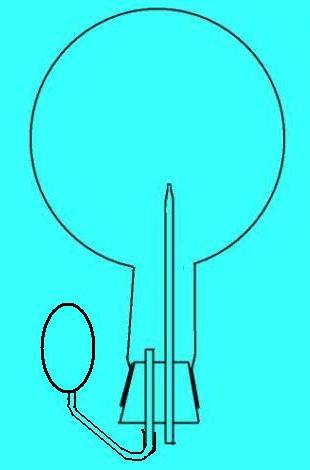 Рис. 1а. Установка для опыта «хлористоводородный» фонтан |
 Рис. 1b. Вместо резиновой пробки с трубками удобно использовать стеклянную насадку Теперь закрепите колбу в штативе (дном вниз) и присоедините к длинной трубке отрезок гибкого шланга. Другой конец шланга соедините с установкой для получения хлороводорода. В нашем случае для этих целей служила обыкновенная колба с газоотводной трубкой. В колбу насыпьте хлорида натрия и налейте туда концентрированной серной кислоты. После этого поставьте колбу в стакан с горячей водой. Такая процедура очень удобна: достаточно вынуть колбочку со смесью из стакана, и выделение газа почти прекратится. Ориентировочным признаком того, что большая колба наполнилась хлороводородом, может служить появление белого тумана соляной кислоты на выходе. |
 Заполним колбу хлороводородом Тем временем, налейте почти доверху воду в кристаллизатор и подкрасьте ее любым индикатором, который изменяет свой цвет в кислой среде — метилоранжем, метиловым красным, лакмусом. Например, в нашем опыте был использован раствор метилового красного с добавками щелочи. Метиловый красный в щелочной среде окрашен в желтый цвет, в кислой — в красный. Когда колба наполнится хлороводородом, отсоедините от нее шланг, по которому поступал газ. Потом к короткой стеклянной трубке присоедините гибкий шланг с резиновой грушей или большим шприцом. Все соединения должны быть плотными. После этого колбу аккуратно переворачиваем (следите, чтобы пробка была плотно закрыта!) и опускаем трубку в кристаллизатор с водой (как можно глубже). |
 |
 Теперь ответственный момент: для того, чтобы в колбе начал бить фонтан, в нее должно попасть несколько капель воды. Для этого воду подают в колбу с помощью шприца или груши [1]. Как только небольшое количество воды попадет в колбу, часть хлороводорода растворится, что приведет к падению давления. В результате в колбу ударит сильный фонтан подкрашенной воды. При этом будут растворяться новые порции HCl и т.д. Желтый раствор метилового красного становился в колбе красным. Фонтан был таким мощным, что когда отверстие оттянутой трубки покрыла вода, он продолжал бить из-под воды, почти не теряя силы. По стенкам колбы текла пленка кроваво-красного раствора, колба отбрасывала красивую красную тень. Если опыт проведен правильно, почти вся колба заполняется раствором, но это бывает далеко не всегда: некоторое количество воздуха поступает через неплотности установки, растворенный воздух выделяется из воды. Кроме того, чистота хлороводорода, который заполнял колбу, разумеется, не достигала 100%. Обратите внимание, что для этого опыта нельзя использовать колбы с плоским дном. Такие колбы легко могут взорваться, когда в них возникнет вакуум. Дело в том, что по поверхности плоскодонных колб сила атмосферного давления распределяется не равномерно, а это довольно значительная величина — около 1 кг на 1 см 2 Вместо хлороводорода используют и другие легко растворимые газы, чаще всего — аммиак. __________________________________________________ |
 »Хлористоводородный» фонтан Fountain Experiment (Hydrogen Chloride) |
 |
| |
 Строго говоря, это эксперимент из области физики, но выглядит он не менее эффектно, чем «хлористоводородный» фонтан. Существенное его преимущество — простота исполнения и отсутствие необходимости работать с опасным хлористым водородом. Для опыта нам понадобятся: литровая круглодонная колба, пробка, в которую вставлена трубка с оттянутым концом [2], кристаллизатор с водой (лучше — подкрашенной) и электрическая плитка. Закрепите в штативе литровую колбу, налейте в нее 5-100 мл воды, неплотно накройте колбу пробкой и поставьте снизу электрическую плитку. Нагрев регулируют таким образом, чтобы вода в колбе активно кипела. Если мощности плитки не достаточно, колбу можно накрыть асбестовой тканью. Когда водяной пар полностью вытеснит из колбы воздух, колбу герметично закрывают пробкой с оттянутой трубкой, аккуратно, переворачивают вверх дном и быстро опускают в кристаллизатор с водой. Колба охлаждается, пар начинает конденсироваться, внутри создается разряжение. В результате, немного холодной воды затягивает в колбу. Это резко усиливает процесс конденсации и через несколько секунд внутри колбы уже бьет мощный фонтан. Как правило, этот фонтан сильнее, чем в опыте с хлористым водородом. Более того, в процессе эксперимента холодная вода в колбе начинает бурно кипеть. Это можно объяснить резким падением давления. Как известно, температура кипения жидкостей значительно уменьшается при низком давлении. __________________________________________________ |
 Подготовка опыта «паровой фонтан» (фонтан в колбе) | |||||||
| Другое отличие эксперимента с водяным паром от предыдущего — подкрашенная жидкость при попадании в колбу не изменяет свой цвет. Но, читатель, безусловно, уже догадался, как этот недостаток устранить. Например, в начале опыта в колбу можно вместо чистой воды добавить слабый раствор нелетучей кислоты или щелочи, а в кристаллизатор — соответствующий индикатор. В следующих номерах журнала мы планируем описать другие аналогичные опыты, в частности, «аммиачный» фонтан. Источник Фонтан опыт по химии16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ! 1602 поступивших (100%) в лучшие вузы Москвы Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве | |||||||
| Записаться в Летнюю школу! | |||||||
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Описание.
При температуре 20 градусов Цельсия 700 объемов аммиака растворяется в 1 объеме воды, поэтому при контакте аммиака с водой происходит его быстрое растворение, давление в колбе падает, и вода с добавленным фенолфталеином под действием разницы давления устремляется в колбу, заполненную аммиаком. Среда в растворе аммиака – щелочная, поэтому из-за добавленного фенолфталеина окраска его становится малиновой.
Родителям и ученикам
- Записаться на курсы
- Пройти online тестирование
- Посмотреть расписание
- Акции и скидки
Образовательный Центр «ПАРАМИТА»
Адрес: г. Москва, ул. Образцова, 14 (2 этаж)
Рядом с метро Достоевская, Марьина Роща, Белорусская
Телефон: 8 (495) 643-69-44
Электронная почта: info@paramitacenter.ru
© 2005 — 2021 Образовательный Центр Парамита
Источник
Фонтан опыт по химии
16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Описание.
Конец резиновой трубки, вставленной в колбу, заполоненной хлороводородом, опускаем в воду, подкрашенную лакмусом. Хлороводород растворяется в воде, давление в колбе падает. И вода фонтаном устремляется в колбу. Образующаяся при растворении в воде соляная кислота, изменяет синюю окраску лакмуса на красную.
Родителям и ученикам
- Записаться на курсы
- Пройти online тестирование
- Посмотреть расписание
- Акции и скидки
Образовательный Центр «ПАРАМИТА»
Адрес: г. Москва, ул. Образцова, 14 (2 этаж)
Рядом с метро Достоевская, Марьина Роща, Белорусская
Телефон: 8 (495) 643-69-44
Электронная почта: info@paramitacenter.ru
© 2005 — 2021 Образовательный Центр Парамита
Источник
Аммиачный фонтан
Вода поглощает аммиак и заполняет колбу
Проведите этот опыт с нашей подпиской!
Этот эксперимент, как и исчезающий порошок и огненная надпись, входит в набор Азот. Подпишитесь и получите всё, что понадобится для проведения этого эксперимента дома.
Реагенты
Безопасность
Перед началом опыта наденьте перчатки.
Проводите эксперимент на подносе.
- Не допускайте попадания химических реагентов в глаза или рот.
- Не допускайте к месту проведения экспериментов людей без защитных очков, а также маленьких детей и животных.
- Храните экспериментальный набор в месте, недоступном для детей младше 10 лет.
- Помойте или очистите всё оборудование и оснастку после использования.
- Убедитесь, что все контейнеры с реагентами плотно закрыты и хранятся по правилам после использования.
- Убедитесь, что все одноразовые контейнеры правильно утилизированы.
- Используйте только оборудование и реактивы, поставляемые в наборе или рекомендуемые текущими инструкциями.
- Если вы использовали контейнер для еды или посуду для проведения экспериментов, немедленно выбросьте их. Они больше не пригодны для хранения пищи.
- В случае попадания реагентов в глаза тщательно промойте глаза водой, при необходимости держа глаз открытым. Немедленно обратитесь к врачу.
- В случае проглатывания реагентов промойте рот водой, выпейте немного чистой воды. Не вызывайте рвоту. Немедленно обратитесь к врачу.
- В случае вдыхания реагентов выведите пострадавшего на свежий воздух.
- В случае контакта с кожей или ожогов промывайте поврежденную зону большим количеством воды в течение 10 минут или дольше.
- В случае сомнений немедленно обратитесь к врачу. Возьмите с собой химический реагент и контейнер от него.
- В случае травм всегда обращайтесь к врачу.
- Неправильное использование химических реагентов может вызвать травму и нанести вред здоровью. Проводите только указанные в инструкции эксперименты.
- Данный набор опытов предназначен только для детей 10 лет и старше.
- Способности детей существенно различаются даже внутри возрастной группы. Поэтому родители, проводящие эксперименты вместе с детьми, должны по своему усмотрению решить, какие опыты подходят для их детей и будут безопасны для них.
- Родители должны обсудить правила безопасности с ребенком или детьми перед началом проведения экспериментов. Особое внимание следует уделить безопасному обращению с кислотами, щелочами и горючими жидкостями.
- Перед началом экспериментов очистите место проведения опытов от предметов, которые могут вам помешать. Следует избегать хранения пищевых продуктов рядом с местом проведения опытов. Место проведения опытов должно хорошо вентилироваться и находиться близко к водопроводному крану или другому источнику воды. Для проведения экспериментов потребуется устойчивый стол.
- Вещества в одноразовой упаковке должны быть использованы полностью или утилизированы после проведения одного эксперимента, т.е. после открытия упаковки.
Часто задаваемые вопросы
Фонтан не получился. В чём дело?
Фонтан мог не получиться по ряду причин.
Колба, в которую вы набираете аммиак, должна быть сухой. Если по какой-то причине она уже была влажной, или при сборе газа в колбу попало слишком много водяного пара, это помешает опыту. Просушите колбу с помощью фена для сушки волос и повторите эксперимент.
Трубки слабо прилегают к пробке, и в колбу попадает воздух. Проверьте положение трубок: они должны быть вставлены плотно и на достаточную глубину.
На конце трубочки, вставляемой в колбу, недостаточно жидкости. Извлеките пробку, повторно наполните газом колбу. Обмакните заострённый конец трубки в растворе тимолового синего (важно проследить, чтобы в кончике трубочки осталась жидкость). После этого закончите эксперимент согласно инструкции.
Пробка плохо закрывала колбу. Очень важно, чтобы пробка плотно прилегала к горлу колбы. Обязательно придерживайте её пальцем!
Другие эксперименты
Пошаговая инструкция
- Высыпьте в пробирку весь оксид кальция CaO из баночки. Чтобы порошок легче высыпался, опустите горлышко баночки в пробирку, и постучите ими по столу.
- В ту же пробирку таким же способом высыпьте весь хлорид аммония NH4Cl из баночки (1 г).
- Поместите пробирку в стакан. Отмерьте в нее 0.5 мл воды.
- Наденьте колбу на пробирку, чтобы собрать выделяющийся газ. Подождите примерно 5 минут, пока смесь не перестанет пузыриться.
- Отмерьте в пластиковый стаканчик по 10 капель 2М раствора гидросульфата натрия NaHSO4 и 0.01М раствора тимолового синего.
- Наполните стакан водой до верха.
- Вставьте трубочки в пробку, как показано на рисунке.
- Обмакните тонкий конец трубки в растворе из пластикового стаканчика.
- Быстро и плотно вставьте пробку в колбу.
- Опустите трубку в раствор в пластиковом стаканчике. Подождите 2 минуты.
- Жидкость поднимется в колбу в виде синего фонтанчика.
Ожидаемый результат
Аммиак, собранный в колбе, активно растворяется в воде. Давление внутри сосуда уменьшается, и жидкость устремляется вверх. Получается настоящий фонтанчик!
Утилизация
Дождитесь остывания пробирки! Закройте пробирку пробкой. Утилизируйте отходы эксперимента вместе с бытовым мусором.
Что произошло
Как образуется аммиак?
При нагревании в пробирке происходит химическая реакция, одним из продуктов которой является аммиак − бесцветный едкий газ с характерным резким запахом.
Дополнение
На самом деле карбонат аммония (NH4)2CO3 и гидроксид кальция Ca(OH)2 не вступают в химическую реакцию напрямую.
Карбонат аммония при нагревании уже до 60 o C легко разлагается на три вещества:
Выделившийся углекислый газ CO2 поглощается гидроксидом кальция:
Вместе эти два процесса можно представить в виде одного уравнения реакции (см. первую часть вопроса). Таким образом, из пробирки выходит только аммиак NH3, необходимый для нашего опыта. Если взять только карбонат аммония, то он будет распадаться гораздо медленнее. При связывании углекислого газа гидроксидом кальция не может проходить обратная реакция – синтез карбоната аммония из продуктов его распада. Из-за этого нужное количество аммиака выделяется из пробирки намного быстрее.
Почему вода начинает поступать в колбу?
Аммиак NH3 очень хорошо растворяется в воде. Поэтому часть аммиака, содержащегося в колбе, быстро растворяется в капле воды на кончике пластиковой трубки. В результате давление в колбе падает, и вода устремляется внутрь под действием атмосферного давления.
Дополнение
Мы не чувствуем давления атмосферы, поскольку наш организм специально приспособлен к жизни на поверхности Земли. В действительности же на нас постоянно давит многокилометровая толща атмосферы.
Убедиться в существовании атмосферного давления можно следующим образом. Нужно налить в большую ёмкость обычную воду, опустить прозрачный высокий стакан полностью под воду, чтобы он наполнился жидкостью. Затем следует аккуратно перевернуть стакан вверх дном и начать его медленно поднимать, при этом не доставая его полностью. Вода не вытекает из стакана, потому что на поверхность воды в ёмкости давит атмосфера! Атмосферное давление в данном случае больше, чем давление жидкости в стакане, поэтому стакан не пустеет. Стоит только оторвать край стакана от поверхности воды, как вода выльется, и её место займёт воздух.
Точно так же атмосферное давление действует и на поверхность жидкости в стаканчике с раствором тимолового синего. После того, как часть аммиака растворяется в капле воды на кончике трубки, давление в колбе становится ниже атмосферного. Теперь атмосфера может вдавить воду внутрь колбы через трубочку, образовав фонтанчик.
Резкое уменьшение давления в колбе возможно только потому, что аммиак обладает очень хорошей растворимостью в воде (около 700 литров в одном литре воды!). Далеко не все газы способны на такое при обычных условиях. Диоксид углерода (CO2 или углекислый газ), например, используют для производства газированных напитков. При этом растворить достаточное его количество в воде можно, только если приложить давление выше атмосферного. Именно поэтому при открывании бутылки с газировкой образуются пузырьки углекислого газа.
Способность многих газов растворяться в жидкости при повышенном давлении может сыграть с человеком злую шутку. Об этом приходится постоянно помнить водолазам и участникам глубоководных экспедиций. Вода намного тяжелее воздуха, поэтому уже на глубине 10 метров давление в два раза больше, чем на поверхности. При погружении на большие глубины газ азот N2 растворяется в крови человека, чего никогда не происходит при обычных условиях. При резком подъёме на поверхность внутри сосудов образуются пузырьки газа, как в открытой бутылке газировки. Это явление называется кессонной болезнью и может привести к крайне тяжёлым последствиям, вплоть до летального исхода.
Почему аммиак хорошо растворяется в воде?
Сложно представить: в одном литре воды можно растворить 700 литров аммиака! Другим газам сложно тягаться с такими показателями. Например, в одном литре воды можно растворить всего 30 мл кислорода O2. Это примерно в 23 000 раз меньше!
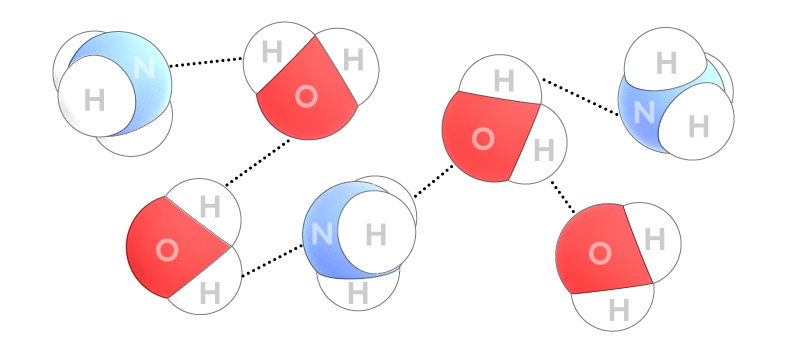
Чем же обусловлено такое различие? Дело в том, что молекулы аммиака способны взаимодействовать с молекулами воды, образовывая при этом так называемые водородные связи. Эти связи гораздо слабее, чем химические, но всё равно способствуют удержанию молекул газа в растворённом состоянии. Кроме этого, в растворе происходит химическое взаимодействие аммиака с водой:
Кислород O2, как и многие другие газы, не склонен к образованию водородных связей. Помимо этого, и химическое взаимодействие между водой и кислородом тоже не происходит.
Дополнение
Что же представляют собой эти водородные связи? Ответ на этот вопрос весьма непрост. Постараемся не углубляться в научные термины и сложные расчёты.
Водородная связь (показана на рисунке пунктиром) – это относительно слабая связь между атомом водорода H и каким-то другим атомом соседней или этой же молекулы (в последнем случае говорят о внутримолекулярной водородной связи). Важно отметить, что атом водорода H, о котором идёт речь, уже связан с другим атомом (связь «O-H» в молекуле воды или связь «N-H» в молекуле аммиака):
Самыми важными различиями между обычной связью «атом-водород» и водородной стоит назвать расстояние между атомами, образующими данную связь, и её энергию (т.е. количество энергии, которую необходимо потратить, чтобы разрушить связь).
Например, атом водорода в молекуле воды находится на расстоянии около 1 А o (А o – ангстрем очень маленькая единица измерения длины, в 1 метре вмещается 10 000 000 000 А o ) от атома кислорода, с которым он связан. Расстояние между этим же атомом водорода и атомом кислорода соседней молекулы, с которым он связан водородной связью, вдвое больше.
Интересно, что именно наличию водородных связей мы обязаны тем, что вода жидкая при нормальных условиях.
Почему так важно не переворачивать колбу?
Аммиак примерно в два раза легче воздуха, поэтому он стремится вверх. Поступающий из пробирки аммиак постепенно заполняет колбу, вытесняя более тяжёлый воздух вниз. Если перевернуть колбу, аммиак тут же улетит, а его место займёт воздух, с которым провести опыт не получится.
Дополнение
Окружающий нас воздух кажется лёгким и невесомым, но это только на первый взгляд. На самом деле он имеет вес! Если положить на одну чашу весов закрытый сосуд, из которого воздух откачан насосом, а на другую – точно такой же закрытый сосуд, но с воздухом, то будет видно, что воздух весит больше, чем ничего.
Ещё в 1811 году учёный Амедео Авогадро выяснил, что в равных объёмах газа при одинаковых условиях содержится одинаковое количество молекул газа. Впоследствии это правило было названо законом Авогадро, в честь первооткрывателя. Таким образом, чем тяжелее молекулы газа, тем тяжелее и сам газ.
Воздух – это смесь газов. В его составе 78,084 % азота (N2), 20,948 % кислорода (O2), 0,934 % аргона (Ar), 0,031 % углекислого газа (CO2). Остальные 0,003 % приходятся на неон (Ne), метан (CH4), гелий (He), криптон (Kr), водород (H2) и ксенон (Xe). Соответственно, воздух чуть тяжелее азота и немного легче кислорода.
Некоторые газы очень лёгкие. Одним из самых лёгких газов является гелий He. Причём он настолько легче воздуха, что может не только улететь сам, но и поднять с собой что-нибудь ещё. Из-за этого свойства гелий используется для наполнения воздушных шаров. Самый лёгкий газ – водород H2. Но использовать его для забав не рекомендуется: он крайне огнеопасен.
Многие газы тяжелее воздуха, и это часто приводит к плачевным последствиям. Некоторые населённые пункты, расположенные в окружённых горами низинах, полностью вымирали из-за природных выбросов таких газов, как сероводород (H2S) и углекислый газ (CO2). Эти газы тяжелее воздуха, поэтому, вырываясь из разломов земной коры или поднимаясь со дна озера, они оттесняют воздух от поверхности земли, что приводит к гибели людей и большинства животных.
Одним из самых тяжёлых при нормальных условиях газов является гексафторид серы (SF6) – элегаз. Его используют в основном физики-ядерщики в качестве газа-изолятора при создании ускорителей частиц. Элегаз настолько тяжёлый, что, если его «налить» в плоскую ёмкость, а сверху аккуратно опустить лодочку, сделанную из алюминиевой фольги, она будет «плавать» на поверхности тяжёлого газа. При этом будет создаваться ощущение, что она буквально парит в воздухе, поскольку элегаз прозрачен.
Почему жидкость меняет свой цвет?
Краситель тимоловый синий относится к группе химических веществ, называемых индикаторами. Его раствор меняет цвет в зависимости от того, сколько ионов водорода (H + ) находится в составе молекулы тимолового синего. Сама молекула индикатора имеет очень сложное строение, поэтому для простоты обозначим её «Ind». Для тимолового синего характерны три формы:
IndH2 IndH — Ind 2-
Каждая из них придаёт раствору свой цвет: IndH2 – красный, IndH — – жёлтый, Ind 2- – синий.
В стакане тимоловый синий находится в основном в форме IndH — , окрашивая раствор в жёлтый цвет. Это происходит благодаря определённому количеству H + в растворе.
При растворении аммиака в воде уменьшается количество свободных ионов водорода H + , ведь им гораздо комфортнее взаимодействовать с молекулой NH3, чем одиноко бродить по раствору:
В связи с этим индикатор переходит в форму Ind 2- , и раствор становится синим.
Это интересно
C какими другими газами можно сделать подобный фонтанчик?
Важным условием получения фонтанчика является большая растворимость газа в воде. Аммиак обладает этим свойством: при комнатной температуре в одном объёме воды может раствориться почти 700 объёмов аммиака. Лучше растворяется в воде только его близкий родственник – метиламин (NH2CH3). Фонтанчик, полученный с помощью метиламина и воды, окрашенной тимоловым синим, ничем не будет отличаться от аммиачного.
Но не только аммиак и его близкие родственники могут быть использованы для подобного опыта. Хлороводород (HCl) и бромоводород (HBr) также хорошо растворимы в воде. В одном объёме воды можно растворить больше 500 объёмов бромистого водорода или почти 450 объёмов хлороводорода. Соответственно, разрежения в колбе будет достаточно, чтобы вода устремилась внутрь под действием атмосферного давления. Только, в отличие от аммиака, хлороводород и бромоводород окрасят раствор тимолового синего в красный или ярко-оранжевый цвет.
Подпишитесь на наборы MEL Chemistry и проведите эти опыты у себя дома!
Источник