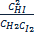Аргентометрия
Аргентоме́три́я, метод титриметрического анализа ( осадительного титрования ), основанный на образовании малорастворимых соединений с ионами серебра (I).
Основной реакцией аргентометрии является:
A g + + X − = A g X ↓ , Ag^++X^-=AgX \downarrow , A g + + X − = A g X ↓ , где X − = C l − , B r − , I − , S C N − X^-= Cl^-, Br^-, I^-, SCN^- X − = C l − , B r − , I − , SC N − и некоторым другим анионы .
Метод применяется в основном для анализа хлорид-, бромид-, иодид- и роданид-ионов. В качестве титранта обычно используется раствор нитрата серебра (I). Конечную точку титрования определяют безындикаторным и индикаторными методами. В зависимости от способа проведения титрования и применяемого индикатора различают следующие 4 варианта метода аргентометрического титрования: Гей-Люссака, Мора, Фаянса и Фольгарда.
Метод Гей-Люссака
Метод прямого титрования хлоридов и бромидов раствором AgNO3 без индикатора. Эквивалентная точка наблюдается по прекращению образования осадка и просветлению титруемого раствора. Метод является одним из точнейших в химическом анализе , но сравнительно продолжителен и требует экспериментального навыка, кроме того, он неприменим для определения иодидов и роданидов , титрование которых сопровождается образованием коллоидных систем и адсорбцией , что затрудняет установление конечной точки титрования.
Метод Мора
Метод заключается в прямом титровании хлоридов и бромидов раствором AgNO3 с образованием нерастворимых осадков в присутствии индикатора – хромата калия . Растворимость хромата серебра Ag2CrO4 значительно выше растворимости галогенидов серебра . Поэтому сначала образуются осадки галогенидов серебра, а при достижении точки эквивалентности, после того как все галогенид-ионы будут осаждены, начинается взаимодействие между хромат-ионами и ионами серебра(I) с образованием осадка кирпично-красного цвета:
2 A g + + C r O 4 2 − = A g 2 C r O 4 ↓ . 2Ag^++CrO>=Ag_2CrO_4 \downarrow . 2 A g + + C r O 4 2 − = A g 2 C r O 4 ↓ . Метод Мора имеет ряд ограничений. Он не применяется для титрования в кислых средах, т. к. хромат-ион переходит в дихромат-ион, а растворимость дихромата серебра значительно выше, чем хромата серебра и конец титрования чётко не определяется. В сильнощелочной среде титрование также не проводят вследствие разложения титранта (AgNO3) с образованием осадка оксида серебра. Неприменим метод Мора для определения иодидов и тиоцианатов, поскольку осадки иодида и тиоцианата серебра хорошо адсорбируют хромат-ионы и точку эквивалентности определить сложно, кроме того, окраска иодида и хромата серебра близки по цвету, что также затрудняет определение конечной точки титрования.
Метод Фаянса
Метод прямого титрования галогенидов раствором AgNO3 в слабокислой среде с применением адсорбционных индикаторов, которые показывают изменение цвета не в растворах, а на поверхности выпавшего осадка. Адсорбционные индикаторы представляют собой слабые органические кислоты, анионы которых изменяют свой цвет, адсорбируясь на поверхности коллоидных частиц осадка солей серебра(I). В качестве адсорбционных индикаторов в аналитической практике чаще всего используют флуоресцеин , дихлорфлуоресцеин, эозин и бромфеноловый синий. Титрование с адсорбционными индикаторами в оптимальных условиях характеризуется высокой точностью и надёжностью. Однако титрование следует выполнять, строго соблюдая определённое значение рН , т. к. это существенно влияет на ионизацию индикатора. Кроме того, титрование с адсорбционным индикатором следует проводить при большой поверхности осадка, что достигается, когда осадок присутствует в виде коллоидных частиц. С этой целью к титруемому раствору прибавляют защитные коллоиды – декстрин , крахмал и др.
Метод Фольгарда
Для определения анионов используется обратное титрование, которое основано на реакции, протекающей между Ag + и SCN – ионами, и выполняется в присутствии индикатора – ионов железа(III). К анализируемому раствору прибавляют минимальный, точно отмеренный объём стандартного раствора нитрата серебра (первый титрант), который реагирует с определяемыми анионами, например хлорид-ионами:
A g + + C l − = A g C l ↓ . Ag^++Cl^-=AgCl \downarrow . A g + + C l − = A g Cl ↓ . Непрореагировавший остаток нитрата серебра оттитровывают стандартным раствором тиоцианата аммония (второй титрант) в присутствии индикатора – ионов Fe 3+ (обычно применяется насыщенный раствор железоаммонийных квасцов ). К анализируемому раствору, содержащему Ag + ионы, приливают по каплям стандартный раствор NH4SCN. При этом образуется малорастворимый осадок:
A g + + S C N − = A g S C N ↓ . Ag^++SCN^-=AgSCN \downarrow . A g + + SC N − = A g SCN ↓ . Образование AgSCN продолжается до тех пор, пока к исследуемому раствору не будет Роданид железа. Роданид железа. прибавлено достаточное количество раствора NH4SCN, эквивалентное содержанию Ag + ионов в анализируемом растворе. Лишняя капля раствора NH4SCN, прибавленная после достижения точки эквивалентности, вызывает появление кроваво-красного окрашивания вследствие взаимодействия SCN – ионов с ионами индикатора: F e 3 + + 3 S C N − = F e ( S C N ) 3 . Fe^+3SCN^-=Fe(SCN )_ 3. F e 3 + + 3 SC N − = F e ( SCN ) 3 . Точку эквивалентности в методе Фольгарда наблюдают по образованию красного окрашивания, вызываемого роданидом железа .
Применение
Из всех методов осадительного титрования аргентометрия является наиболее распространённой в аналитической практике. Её используют в анализе как органических, так и неорганических веществ. При экологическом контроле метод применяется при анализе природных и промышленных сточных вод . В агрохимии – для анализа почвы , почвенных вытяжек, удобрений и других объектов. Аргентометрические методы являются фармакопейными и используется для анализа лекарственных средств .
Наиболее широкое применение в практике имеет метод Фольгарда (тиоцианатометрия), с помощью которого находят содержание галогенидов в кислой среде. Кроме галогенидов, этим методом можно определять арсенаты, оксалаты , фосфаты , сульфиды и другие анионы, образующие малорастворимые соединения с ионом Ag + . Менее широкое применение имеет метод Мора и ещё меньшее – применение адсорбционных индикаторов.
Современным развитием аргентометрии является использование для определения конечной точки титрования потенциометрического метода. Вместо индикаторов при этом применяется индикаторный серебряный электрод , потенциал которого зависит от концентрации ионов серебра в растворе. Скачок потенциала соответствует точке эквивалентности. Достоинством потенциометрического титрования является высокая точность и воспроизводимость определений. Т. к. анализ выполняется с помощью объективных данных прибора, то исключается визуальная ошибка при нахождении точки эквивалентности.
Источник
Аргенометрия. Методы Мора и Фольгарда.
Аргенометрия-метод объемного анализа, основанный на применении стандартного раствора нитрата серебра. Различают несколько методов аргенометрии: метод просветления, метод Мора, метод Фольгарда, метод Фаянса.
Метод Мора применяется для определения бромидов и хлоридов. Он основан на реакции, протекающей между Ag + и Cl — ,выполняется в присутствии индикатора – раствора хромата калия. Лишняя капля титрованного раствора AgNO3, прибавленная после достижения точки эквивалентности, вызывает выпадение кирпично-красного осадка Ag2CrO4, образующегося в результате взаимодействия Ag + с ионами индикатора: 2Ag + +CrO4 -2 =Ag2CrO4. Этот метод выполняется только в нейтральной или слабощелочной среде. В сильнощелочной среде образуется AgOH, который сразу же распадается на Ag2O и H2O: 2Ag + OH — =Ag2O+H2O.
Метод Фольгарда, основанный на реакции, протекающей между Ag + и SCN — , выполняется в присутствии индикатора- насыщенного раствора железлоаммонийных квасцов, содержащих ионы железа. Ag + +SCN — =AgSCN.
Лишняя капля раствора NH4SCN, прибавленная после достижения точки эквивалентности, вызывает появление кроваво-красного окрашивания раствора вследствие взаимодействия SCN — с ионами Fe +3 индикатора: Fe +3 +3SCN — =Fe(SCN)3. Этот метод применяется в нейтральной и кислой среде. В щелочной среде Fe +3 образует осадок Fe(OH)3, а Ag + может образовать осаок Ag2O.
9. Термохимические уравнения и расчеты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
Уравнения химических реакций, в которых записывается величина теплового эффекта, называются термохимическими. Для определения теплового эффекта используется калориметр, снабженный точным термометром. Количество теплоты, выделяющейся в калориметре, определяют по общей теплоемкости всех частей калориметра и изменению температуры: Q=C∆t, С=m1c1+m2c2.
Закон Гесса гласит: тепловой эффект реакции зависит только от природы и состояния исходных веществ и конечных продуктов и не зависит от пути, по которому реакция протекает.
1 следствие из закона Гесса: тепловой эффект реакции равен сумме теплот образования продуктов реакции минус сумма теплот образования исходных веществ.
2 следствие из закона Гесса: тепловой эффект реакции равен сумме теплот сгорания исходных веществ минус сумма теплот сгорания продуктов реакции.
Стандартной теплотой образования называется тепловой эффект образования 1 моль сложного вещества из простых веществ при стандартных условиях.
Стандартной теплотой сгорания называется тепловой эффект сгорания 1 моль органического вещества до Co2 и H2O при стандартных условиях, а если речь идет о неорганических веществах, то указываются степени окисления продуктов сгорания.
Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
Состояние реагирующих веществ, при котором скорость прямой реакции равна скорости обратной реакции называется состоянием химического равновесия. Состояние химичесчкого равновесия характеризуется константой равновесия K. Так, для реакции H2+I2=2HI
K=
В 1884г. Французский ученый Ле-Шателье сформулировал принцип подвижного равновесия: при изменении каких-либо параметров системы, находящейся в химическом равновесии, происходит смещение его в направлении, при котором уменьшается влияние этого изменения.
Химическая кинетика, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
Кинетика-наука, изучающая механизм и закономерности протекания химических реакций. В хим.кинетике используется графический метод изображения функциональных зависимостей.
Vср.= 


Скоростью химической реакции называется изменение концентрации реагирующих веществ в единицу времени.
Vср.=lim(



Источник